1、填空题 环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质
| 沸点(℃)
| 密度(g·cm-3,20℃)
| 溶解性
|
环己醇
| 161.1(97.8)★
| 0.9624
| 能溶于水
|
环己酮
| 155.6(95)★
| 0.9478
| 微溶于水
|
水
| 100.0
| 0.9982
| ?
|
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为??。
②蒸馏不能分离环己酮和水的原因是??。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分;? b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是??(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需??。
③在上述操作c中,加入NaCl 固体的作用是??。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有?种不同化学环境的氢原子。
参考答案:(1)①缓慢滴加?②环己酮和水形成具有固定组成的混合物一起被蒸出
(2)①c d b a?②漏斗、分液漏斗?③增加水层的密度,有利于分层
(3)3
本题解析:(1)①由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副
反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应用酸式滴定管缓慢滴加。
②环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被
一起蒸出,所以蒸馏难以分离环己酮和水的混合物。
(2)①见答案?②根据操作过程找出还需要的玻璃仪器有漏斗、分液漏斗。
③联系制取肥皂的盐析原理,即增加水层的密度,有利于分层。
(3)因为环己酮的结构简式为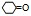 ,所以环己酮分子中有3种不同化学环境的氢原子。
,所以环己酮分子中有3种不同化学环境的氢原子。
本题难度:一般
2、填空题 ( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:

①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
?
??。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是?。
?(2)?该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是??(填代号)
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸,则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
参考答案:(1)①Mg2++2OH-===Mg(OH)2↓? Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2—+2H2O?②Cl-、AlO2—、OH-?
因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2—时,需要控制溶液
的pH,以防止部分氢氧化铝转化成Al3+;通入过量二氧化碳气体?(2)C
本题解析:略
本题难度:一般
3、选择题 下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
| 物质 | 试剂]
A
Na2SO4溶液(NaBr)
Cl2
B
FeCl2溶液(FeCl3)
Cu
C
Cl2(HCl)
饱和食盐水
D
CO2(HCl)
饱和Na2CO3溶液
|
A.A
B.B
C.C
D.D
参考答案:A.发生2NaBr+Cl2=2NaCl+Br2,生成NaCl,引入新杂质,故A错误;
B.生成CuCl2,引入新杂质,应用Fe除杂,故B错误;
C.Cl2不溶于饱和食盐水,可用饱和食盐水除杂,故C正确;
D.CO2和HCl都可与饱和Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下列有关除杂质(括号中为杂质)的操作中,错误的是
[? ]
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列物质的提纯或离子检验的方法正确的是?
A.用渗析的方法精制氢氧化铁胶体
B.以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
C.除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D.加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32—
参考答案:A
本题解析:胶体不能透过半透膜,而溶液可以透过半透膜,利用渗析可以精制胶体,A正确;以粗铜为阳极,精通为阴极,CuSO4溶液为电解液精炼铜,选项B不正确;C不正确,过滤后还要加入适量的盐酸酸化;D不正确,因为能和澄清石灰水反应的不止碳酸盐,还可以是碳酸氢盐,答案选A。
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般