1、填空题 在一定条件下,二氧化硫和氧气发生 如下反应:
2SO2(g)+ O2 (g) 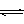 ?2SO3(g)? (△H< 0)
?2SO3(g)? (△H< 0)

(1)降低温度,二氧化硫转化率_________,化学反应速率_? (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间____?。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是?__?___(用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂? b.缩小容器体积?
c.降低温度? d.增加SO3的物质的量
参考答案:(1)增大,减小
(2)15—20min和25—30min。
(3)增加了O2的浓度?(4)a 、 b
本题解析:(1)正反应为放热反应,降低温度,平衡右移,SO2转化率降低,反应速率减小;(2)处于平衡状态,即各物质的物质的量浓度不再变化;(3)反应进行至20min时,氧气的浓度骤增,SO2和SO3浓度不变,故此时是增加了O2的浓度;(4)10min到15min中,单位时间内各物质的浓度的变化量增大,则反应速率增大;加入催化剂,缩小容器容积,增大压强,升高温度,增大某气体的浓度,都可以加大反应速率;但是增加SO3的物质的量,图中SO3的浓度应该骤增,而不是逐渐增大,故d不符合。
点评:化学平衡与化学速率是历年高考必考知识点,考生在备考过程中要注意分别两者的影响因素。
本题难度:一般
2、选择题 将4molA和2molB放入2L密闭容器中发生反应
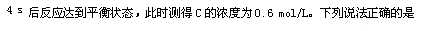
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
参考答案:A
本题解析:A:υ(C)=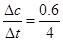 =0.15 mol/(L ·s),依据系数比可推出υ(B)=0.075 mol/(L ·s),正确
=0.15 mol/(L ·s),依据系数比可推出υ(B)=0.075 mol/(L ·s),正确
B:c(A)︰c(B)︰c(C)=2︰1︰2只是一个特定状态,与是否平衡没有直接关系,排除
C:升温,平衡左移,则C的物质的量浓度减小,排除
D:缩小容器体积,相当于加压,平衡正向移动,A的转化率增大,排除
答案为A
本题难度:一般
3、选择题 已知反应mX(g)+nY(g)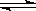 qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是
qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是
A.如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B.此时,X的正反应速率是Y的逆反应速率的m/n倍
C.如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D.如果增加X的物质的量,平衡正向移动,X的转化率增大
参考答案:B
本题解析:略
本题难度:简单
4、选择题 在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.15℃时氨基甲酸铵的分解平衡常数为2.048×10-9(mol/L)3
C.恒温下压缩体积,NH3的体积分数减小
D.再加入一定量氨基甲酸铵,可加快反应速率
参考答案:B
本题解析:A、反应物为固体,生成物全部为气体,从反应开始到平衡状态,气体的平均相对分子质量始终是(2×17+44)/3=26,错误;B、15℃时,平衡气体总浓度为2.4×10-3mol/L,则平衡时氨气浓度是1.6×10-3mol/L,二氧化碳浓度是0.8×10-3 mol/L,K=c2(NH3)c(CO2)=2.048×10-9(mol/L)3,正确;C、恒温下压缩体积,压强增大,平衡虽然逆向移动,但NH3与CO2的物质的量比始终是2:1,所以NH3的体积分数不变,正确;D、氨基甲酸铵是固体,再加入一定量氨基甲酸铵,对反应速率无影响,错误,
答案选B。
本题难度:一般
5、填空题 已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
⑴能说明上述反应已经达到化学平衡状态的是?(填写序号)
a.v(C)=2v(B)? b.容器内压强保持不变
c.v逆(A)=2v正(B)? d.容器内气体的密度保持不变
⑵若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为?(用含Q1、Q2的代数式表示);
⑶500℃时,上述反应的化学平衡常数K=?;
⑷已知:K(300℃)>K(350℃),该反应是?(填“放”或“吸”)热反应;若反应温度升高,A的转化率?(填“增大”、“减小”或“不变”);
⑸某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)?K(B)(填“>”、“<”或“=”)。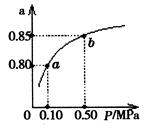
参考答案:(1)bc (2)Q1=4Q2 (3)3200 (4)放热?减小?(5)=
本题解析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。选项a中不能确定反应速率的方向,因此不能确定是否达到平衡状态,a不正确;该反应是体积减小的可逆反应,反应过程中压强是减小的,所以当容器内气体的压强不再发生变化时可以说明达到平衡状态,b正确;c中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,可以说明达到平衡状态,c正确;密度是混合气的质量和容器容积的比值,在反应过程中容积内气体的质量和容器容积始终是不变的,即密度始终是不变的,因此选项d不能说明,答案选bc。
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡,则该平衡状态与题干中的平衡状态是相同的。原平衡中,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。则该该平衡状态中平衡时c(C)=0.040 mol·L-1,即消耗C的浓度是0.010 mol·L-1,所以Q1=4Q2。
(3)? 2A(g)+B(g) 2C(g)
2C(g)
起始浓度(mol/L)? 0.050? 0.025? 0
转化浓度(mol/L)? 0.040? 0.020? 0.040
平衡浓度(mol/L)? 0.010? 0.005? 0.040
所以平衡常数K=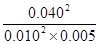 =3200
=3200
(4)已知:K(300℃)>K(350℃),这说明升高温度,平衡向逆反应方向移动,所以该反应是放热反应;因此若反应温度升高,A的转化率减小。
(5)对于特定的可逆反应,平衡常数只与温度有关系,改变压强平衡不移动,则化学平衡常数K(A)=K(B)。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。该题的难点是等效平衡的应用。
本题难度:一般