1、选择题 在一定温度下的恒容容器中,反应A(s)+2B(g)  ?C(g)+D(g)已达平衡状态的是
?C(g)+D(g)已达平衡状态的是
A.混合气体的压强不随时间变化而变化
B.混合气体的密度不随时间变化而变化
C.气体总物质的量不随时间变化而变化
D.单位时间内生成n mol C,同时消耗2n mol B
参考答案:B
本题解析:略
本题难度:简单
2、选择题 在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)  2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是?
2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是?
 ?
?
A.a的温度高于b
B.a使用了催化剂,而b未用
C.a的压强大于b
D.a的温度低于b
参考答案:B
本题解析:a先达到平衡,b后达到平衡,说明a反应速率比b反应速率快,所以升温、加压、使用催化剂都可以,但平衡后,C%相同,说明平衡没有移动,但升温、加压平衡都移动,所以只有使用催化剂,催化剂只加快反应速率,不影响平衡移动,故选B。
本题难度:一般
3、填空题 一定温度下,将2mol A和2mol B两种气体混合于体积为2 L的某恒容的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),
xC(g)+2D(g),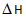 <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
<0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于_________,
(2)该反应的化学平衡常数K=_________,升高温度时K值将_________(填“增大”、“减小”、“不变”)
(3)A物质的转化率为_________。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_________mol;达新平衡时,A的物质的量为n(A)=_________mol。
参考答案:(1)2
(2)0.5;减小
(3)60%
(4)3;2.6
本题解析:
本题难度:一般
4、选择题 某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( ? )
?
| A
| B
| C
|
Ⅰ
| 0.050mol·L-1
| 0.050mol·L-1
| 0.050mol·L-1
|
Ⅱ
| 0.070mol·L-1
| 0.070mol·L-1
| 0.098mol·L-1
|
Ⅲ
| 0.060mol·L-1
| 0.060mol·L-1
| 0.040mol·L-1
|
Ⅳ
| 0.080mol·L-1
| 0.080mol·L-1
| 0.12mol·L-1
|
?
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
参考答案:D
本题解析:A、把平衡时各物质的浓度代入平衡常数表达式进行计算得:KⅠ = 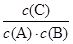 ?=
?=  = 20mol-1·L,正确;B、计算平衡常数:KⅡ =
= 20mol-1·L,正确;B、计算平衡常数:KⅡ = 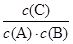 ?=
?= 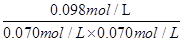 ?= 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ =
?= 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ = 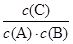 ?=
?=  ?= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
?= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
本题难度:一般
5、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9
B.16
C.20
D.25
参考答案:C
本题解析:
依题意得,平衡时c(HI)=4mol?L-1,HI分解生成的H2的浓度为0.5mol?L-1,NH4I分解生成的HI的浓度为4mol?L-1+2×0.5mol?L-1=5mol?L-1,故NH4I分解生成的NH3的浓度为5mol?L-1,所以反应①的平衡常数k=c(NH3)?c(HI)=5mol?L-1×4mol?L-1=20mol2?L-2。答案选C。
本题难度:一般