1、选择题 在一个的固定容积的密闭容器中,可逆反应:2 SO2?+? O2  ?2 SO3?达到平衡的标志是
?2 SO3?达到平衡的标志是
A.SO2、O2、SO3的浓度之比为 2 : 1 : 2
B.SO2、O2、SO3的浓度均不再变化
C.单位时间内消耗1molO2同时生成2molSO3
D.SO2、O2、SO3共存
参考答案:B
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以选项B正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项A是错误的;C中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确,D中只要是可逆反应,均满足反应物和生成物同时存在,答案选B。
点评:该题是高考中的常见考点,属于中等难度的试题,主要是考查学生对可逆反应平衡状态的熟悉了解程度,有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是理解并能熟练记住可逆反应的平衡状态特点,然后结合具体的方程式灵活运用即可。有利于调到学生的学习兴趣和学习积极性。
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是
 ?
? ?
? ?
?
甲?乙?丙?丁
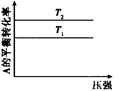
A.图甲可以判断出反应A(g) + B(g) 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B.图乙表示压强对可逆反应2A(g) + 2B(g) 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
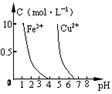
C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
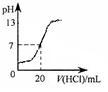
D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化
参考答案:C
本题解析:A、由图甲可知,增大压强A的转化率不变,反应前后气体的物质的量相等;A转化率温度T2时比温度T1时高,不能判断温度高低与反应热效应,故A不正确;B、由图乙可知,乙的反应速率大于甲的,但平衡时反应物的含量不变,说明反应前后体积不变,因此选项B不正确;C、根据图丙可知,溶液中pH=4使,氢氧化铁几乎完全沉淀,而氢氧化铜还没有开始沉淀,因此选项C正确;D、滴定前氢氧化钠溶液的pH=13,因此选项D不正确,答案选C。
本题难度:一般
3、选择题 在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g) 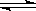 ?3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
?3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化;?④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3;?⑥混合气体的密度不再变化;
A.①③⑥? B.①③④⑥? C.①②③? D.①③④⑤
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项①③正确。②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不能说明。该反应是体积不变的可逆反应,所以容器内气体的压强始终是不变的,④不能说明;平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,⑤不能说明。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此选项⑥可以说明,答案选A。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
4、选择题 在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是?(?)
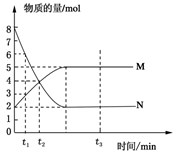
A.t2时M与N的物质的量浓度之比为1:1
B.t2与t3时刻的混合气体的平均相对分子质量相等
C.反应物与生成物平衡时的物质的量浓度之比是2:5
D.0~t2内用M表示的平均反应速率是 mol/(L?min)
mol/(L?min)
参考答案:B
本题解析:根据图像可知,反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol;M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,根据物质的量的变化与化学计量数呈正比,则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是
M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是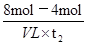 =
= mol/(L?min),所以选项D正确,答案选B。
mol/(L?min),所以选项D正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,意在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意把握图象中曲线的变化特点。
本题难度:一般
5、选择题 可逆反应?N2+H2?2NH3?是一个放热反应.有甲、乙两个完全相同的容器,向甲容器中加入1mol?N2和3mol?H2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2mol?NH3,达平衡时,吸收的热量为Q2.已知Q2=4Q1,则甲容器中,H2的转化率为( )
A.20%
B.25%
C.75%
D.80%
参考答案:由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即三种气体的浓度完全相同,对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反.N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q,
假设甲容器中的参加反应的氮气的物质的量为xmol,所以:
对于甲容器:N2(g)+3H2(g)?2NH3(g)△H=-QkJ/mol
起始(mol):1? 3? ?0
变化(mol):x? 3x? 2x
平衡(mol):1-x? 3-3x?2x
所以Q1=xQkJ,
乙容器反应混合物各组分的物质的量也是为N2(1-x?)mol、H2(3-3x?)mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,
对于乙容器:2NH3(g)?N2(g)+3H2(g)△H=+QkJ/mol,故吸收的热量Q2=2-2x2QkJ=(1-x)QkJ,
所以(1-x)Q=4xQ,解得x=0.2,所以H2的转化率为0.2mol×33mol=20%,
故选A.
本题解析:
本题难度:一般