1、选择题 在可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
A.升高温度
B.降低温度
C.使用催化剂
D.增大CO浓度
参考答案:B
本题解析:不论反应是放热还是吸热,升高温度会增大反应速率,而降低温度会减慢反应速率;增大反应物浓度,加快反应速率。
本题难度:一般
2、简答题 下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25
MgO膜厚Y(nm)
0.02a
0.08a
0.18a
0.32a
0.50a
ZnO膜厚Y(nm)
1.0×10-3b
4.0×10-3b
9.0×10-3b
1.6×10-2b
2.5×10-2b
NiO膜厚Y(nm)
0.3c
0.6c
0.9c
1.2c
1.5c
|
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:______;ZnO:______.
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:______.
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是______.
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
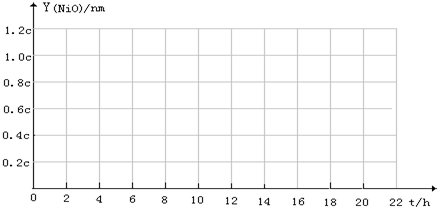
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:______.
参考答案:(1)由表中数目可知MgO膜厚Y是时间的0.02a倍,膜厚Y与时间t的函数关系式为Y=0.02at,ZnO 膜厚Y是时间的1.0×10-3b倍,膜厚Y与时间t的函数关系式为Y=1.0×10-3bt,
故答案为:Y=0.02at;Y=1.0×10-3bt;
(2)金属锌在此高温下1-25h内的氧化腐蚀速率为2.5×10-2bnm25h=1.0×10-3b(nm/h),
故答案为:1.0×10-3b(nm/h);
(3)比较三种金属的氧化腐蚀速率,应在相同的条件下比较,除了温度相同外,氧气的浓度、固体的表面积和形状应相同,
故答案为:氧气的浓度(相等)和金属的表面积(相同)或金属的形状(相同);
(4)根据表中数据可得出镍的膜厚Y与时间t的函数关系式为y=0.3
本题解析:
本题难度:一般
3、选择题 在密闭容器中发生可逆反应4NH3+5O2 4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是?
4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是?
A.v(O2)=0.001mol/(L·S)
B.v(NH3)="0.002" mol/(L·S)
C.v(H2O)="0.003" mol/(L·S)
D.v(NO)="0.008" mol/(L·S)
参考答案:D
本题解析:对应同一个化学反应,用不同的物质表示其反应速率数值是不同的,但表示的意义是相同的。因此在比较反应速率时需要换算成用同一种物质来表示,然后才能直接比较数值大小。若都用氨气表示其反应速率,则A、B、C、D分别为0.0008mol/(L·S)、0.002 mol/(L·S)、0.002 mol/(L·S)、0.002 mol/(L·S)、0.008 mol/(L·S)。所以答案是D。
本题难度:一般
4、实验题 某研究性学习小组设计了如下二组实验:
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。
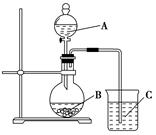
设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3溶液改成物质的量浓度为 mol/L的Fe2(SO4)3溶液。
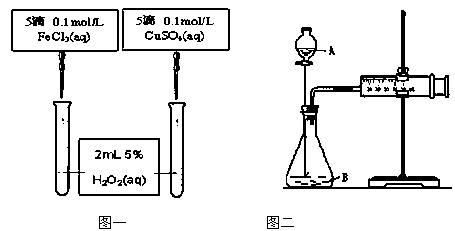
(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
参考答案:(I) (1)HNO3 CaCO3 Na2SiO3(或K2SiO3)(3分)
(2) CO2+SiO+H2O===H2SiO3↓+CO(2分)
或2CO2+SiO+2H2O===H2SiO3↓+2HCO
(II)⑴反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度);(2分)
控制阴离子相同,排除阴离子的干扰;(2分) 0.05mol/L Fe2(SO4)3;(2分)
⑵关闭A处活塞,将注射器活塞拉出一定距离,松开活塞,一段时间后观察活塞是否回到原位;(2分)
本题解析:实验验证元素周期律中, 非金属元素的非金属性越强,非金属性C>Si ,
CO2+SiO+H2O===H2SiO3↓+CO.强酸制弱酸,碳酸的酸性强于硅酸。
比较Fe3+和Cu2+对H2O2的催化效果,看反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度);
本题难度:困难
5、填空题 向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)=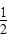 v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了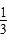 ,B的物质的量减少了
,B的物质的量减少了 ?mol,有a mol D生成,回答下列问题:
?mol,有a mol D生成,回答下列问题:
(1)反应2 min内v(A)=________,v(B)=________
(2)化学方程式中,x=__________,y=__________,p=________,q=________
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”、“减小”或“不变”),理由是________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是________。
参考答案:(1)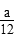 ?mol·L-1·min-1?
?mol·L-1·min-1? ?mol·L-1·min-1
?mol·L-1·min-1
(2)2 3 1 6 (3) ×100% (4)<
×100% (4)<
(5)①增大 体积减小,反应物的浓度增大,因而使反应速率增大
②减小 体积减小,气体的压强增大,平衡向气体体积减小的方向(即逆反应方向)移动,因而使反应物转化率减小
本题解析:(1)v(A)=Δc(A)/Δt=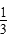 a/(2×2) mol·L-1·min-1=
a/(2×2) mol·L-1·min-1= a mol·L-1·min-1
a mol·L-1·min-1
v(B)=Δc(B)/Δt=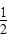 a/(2×2) mol·L-1·min-1=
a/(2×2) mol·L-1·min-1= a mol·L-1·min-1
a mol·L-1·min-1
(2)v(C)=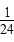 a mol·L-1·min-1
a mol·L-1·min-1
v(D)= a mol·-1·min-1,所以x∶y∶p∶q=
a mol·-1·min-1,所以x∶y∶p∶q= ∶
∶ ∶
∶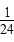 ∶
∶ ,则x=2 y=3 p=1 q=6
,则x=2 y=3 p=1 q=6
(3) 2A(g)+3B(g) C(g)+6D(g)
C(g)+6D(g)
起始/mol a b 0
变化/mol? a? 2a
平衡/mol? 2a
所以α(B)= ×100%。
×100%。
(4)其他条件不变,升高温度,平衡时D的量减少,说明升高温度平衡向左移动,即正反应为放热反应。
(5)其他条件不变缩小体积,浓度增大,所以反应速率增大;该反应是气体体积增大的反应,缩小体积,平衡将向体积缩小的方向移动,即向左移动,所以反应物的转化率减小。
本题难度:一般