|
|
|
高考化学知识点归纳《大气污染与治理》高频试题预测(2019年最新版)(八)
2020-07-08 01:46:05
【 大 中 小】
|
1、填空题 (14分)某校高一研究性学习小组将造成我省某市空气污染的主要原因分为以下四种:
A.燃烧农作物秸秆
B.燃烧含硫煤
C.粉尘污染
D.机动车尾气污染
| 并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
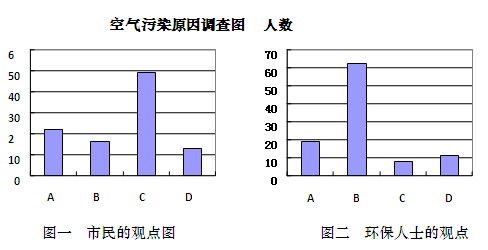
(1)调查结果显示:该市市民认为造成空气污染的最主要原因是?,环保人士认为造成该市空气污染的最主要原因是?。
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是?,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为??
(3)下列措施能够减少空气中该成分排放量的是?
①用天然气代替煤炭做民用燃料?②改进燃烧技术,提高热能利用率?③工厂生产时将燃煤锅炉的烟囱造得更高?④燃煤中加入适量石灰石后使用
参考答案:(14分) (1)C(2分)? B(2分)
(2)SO2? (2分)? 2SO2+O2+2H2O=2H2SO4(4分)
(3)①②④(4分,少一个扣2分)
本题解析:⑴从图表知该市市民认为造成空气污染的最主要原因是粉尘污染,环保人士认为造成该市空气污染的最主要原因是燃烧含硫煤;⑵燃烧含硫煤产生SO2污染;⑶天然气中的含硫量较煤少,改进燃烧技术可减少硫的排放,燃煤中加入适量石灰石可起到固硫作用,工厂生产时将燃煤锅炉的烟囱造得更高并不能减少的SO2排放,故选①②④。
本题难度:一般
2、选择题 下列对应关系正确的是
A
| B
| C
| D
| 
| 
| 
| 

| 浓硫酸
| 氢氧化钠
| 废旧灯管
| 废旧易拉罐
参考答案:D
本题解析:A、浓硫酸属于易腐蚀液体,错误;B、氢氧化钠不是氧化剂,属于易腐蚀固体,错误;C、废旧灯管不是厨余垃圾,是有害垃圾错误;D、废旧易拉罐可回收再利用,属于可回收物,正确,答案选D。
本题难度:简单
3、填空题 (12分)当今水体的污染成为人们关注的焦点。利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol·L-1时,溶液中c(PO43-)=???mol·L-1。
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为?;与方法一相比,方法二的优点为?。
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为?。
(3)工业上也会利用铝粉除去含氮废水中的NO3-。现在处理100m3浓度为2.0×10-4 mol·L-1的NaNO3溶液,加入一定量的2 mol·L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4∶1,求此过程中消耗铝的质量。(写出计算过程,无过程以0分计算)
?
参考答案:(1)①5.0×10-7?(2分)
②当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动;(2分)能同时除去废水中的氮,充分利用了镁矿工业废水?(2分)
(2)50 mol(根据2Al + NO2―+OH―+ 2H2O=2AlO2―+ NH3·H2O计算,训练单位换算)
(2分)
(3)参加反应的n(NaNO3)=100m3×103 L·m-3×2.0×10-4 mol·L-1×1/2=10mol  ?(4分) ?(4分)
[方法1] 根据方程式:16Al + 9NO3―+7OH―=16AlO2―+ 4N2↑+ NH3↑+ 2H2O?
16? 9
n(Al)? 10mol?
n(Al) =160/9mol?
[方法2] 根据氮原子守恒,还原产物氮气和氨气中的氮原子之比为8∶1,即可得:
生成的n(N2)=(10mol×8/9)/2=40/9mol;n(NH3)=10mol×1/9=10/9mol?
根据电子转移守恒,可得:
40/9mol×10+10/9mol×8=n(Al)×3;n(Al)=160/9mol ? ? ?
此过程中消耗m(Al)=160/9mol×27 g·mol-1=480g?
[其他合理解答也给分]
本题解析:略
本题难度:一般
4、填空题 (12分)(1)(4分)下列药物:
A.阿司匹林
B.胃舒平
C.青霉素
D.吗啡。其药物功效是(填序号)
|
①属解热镇痛药____________________;②属抗生素药_ _______;
③属麻醉剂___ ____________;④属抗酸药_________________________。
(2))(2分)在药物包装盒上标有_____________的表示处方药,标有__________的表示非处方药(填“OTC”或“R”)
(3)(6分)垃圾处理的基本原则:________________、________________、________________。
垃圾做一般处理的主要方法:___________________、___________________、__________________。
参考答案:(12分)?(1) A? C?D? B?(2) R? OTC
(3)无害化、减量化、资源化?卫生填埋、堆肥、焚烧
本题解析:(1)考查常见药物的用途。
(2)药物包装盒上标有R表示的是处方药,OTC表示非处方药。
(3)垃圾处理的基本原则是无害化、减量化、资源化。主要方法是卫生填埋、堆肥、焚烧。
本题难度:简单
5、选择题 1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别是b mol·L-1和2b mol·L-1,现用一种试剂(适量)把Ca2+、Mg2+除去,这种试剂最好选用? ( )。
A.Ca(OH)2
B.NaOH
C.NaHCO3
D.Na2CO3
参考答案:B
本题解析:由于Mg(OH)2的溶解度比MgCO3的小,故Mg2+的除去应用OH-,Ca2+的除去应用CO32-;若加入过量Ca(OH)2,发生反应Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O,CaCl2中的Ca2+仍没有除去,过量的Ca(OH)2又会产生Ca2+。若选用NaOH只需4b mol即可。
本题难度:一般
|
