1、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
[? ]
A.一个D2O分子所含的中子数为8
B.NH3的结构式为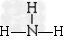
C.HCl的电子式为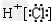
D.热稳定性:H2S>HI
参考答案:B
本题解析:
本题难度:简单
2、选择题 某元素的原子结构示意图为 ,该元素位于元素周期表中
,该元素位于元素周期表中
[? ]
A.第三周期、ⅢA族
B.第三周期、ⅡA族
C.第二周期、ⅢA族
D.第二周期、ⅡA族
参考答案:B
本题解析:
本题难度:简单
3、选择题 对于核电荷数为37的元素,下列描述正确的是
A.原子半径比钾原子半径小
B.其单质常温下跟水反应不如Na剧烈
C.碳酸盐易溶于水
D.氢氧化物不能使Al(OH)3溶解
参考答案:C
本题解析:37号元素的核外电子排布为2、8、18、8、1,所以在第5周期ⅠA族,为RB其性质与Na、K相似,且在钾的下面.K比Na的性质活泼,Rb应更活泼;Rb与水反应比K剧烈,原子半径比K大,RbOH的碱性比KOH强,Rb2CO3比K2CO3更易溶于水.K比Na弱的性质,Rb应更弱:熔点比K低,密度比K大.
本题难度:困难
4、选择题 下列排列顺序不正确的是( )
A.粒子半径:Al3+<Mg2+<F-
B.热稳定性:HI>HBr>HCl>HF
C.酸性:H2SiO3<H3PO4<H2SO4<HClO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
参考答案:A.Al3+、Mg2+、F-都具有相同的核外电子排布,核外电子排布相同的离子,核电核数越大,半径越小,则有粒子半径:Al3+<Mg2+<F-,故A正确;
B.元素的非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则热稳定性:HI<HBr<HCl<HF,故B错误;
C.元素的非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性为H2SiO3<H3PO4<H2SO4<HClO4,故C正确;
D.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确.
故选B.
本题解析:
本题难度:简单
5、选择题 如图是元素周期表的另一种形式.下列有关叙述正确的是
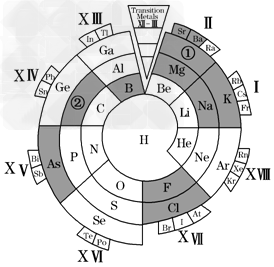
[? ]
A.图中标明的元素均为主族元素
B.图中①号元素的一种碳化物与水反应可生成乙炔
C.图中②号元素的最高价氧化物既能溶于强酸又能溶于强碱
D.图中P的氢化物的电子式为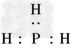 ?
?
参考答案:B
本题解析:
本题难度:简单