1、选择题 已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是(?)
A.四种元素位于同一周期
B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:aW3+>bX+
D.a+3=c-2
参考答案:C
本题解析:aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即这四种微粒的核外电子数相等。A.由于阳离子是原子失去电子形成的,形成的离子比原子少一个电子层;阴离子是原子获得电子形成的,离子的电子层数与原子相同。所以四种元素位于不同的周期。错误。B.由于Z、Y在同一周期,非金属性Z>Y。元素的非金属性越强,其对应的氢化物就越温度。故氢化物的稳定性: HZ >H2Y。错误。C.对于电子层结构相同的离子来说,离子的核电荷数越大,离子的半径就越小,离子的氧化性就越强。由于核电荷数离子aW3+>bX+,所以离子的的氧化性:aW3+>bX+。正确。D. aW3+是原子失去3个电子形成的,cY2-是原子获得2个电子形成的,由于二者的电子数相等,所以a-3=c+2.错误。
本题难度:一般
2、填空题 A~F均为元素周期表中前四周期元素,其相关信息如下表:
元素
| 相?关?信?息
|
A
| A的基态原子最外层电子排布式为2s22p3
|
B
| B是地壳中含量最高的元素
|
C
| C+与B的简单离子的电子层结构相同
|
D
| D的一种核素的质量数为64,中子数为35
|
E 、F
| E 、F既同周期又同族,且原子序数F比E多2
|
?
请回答下列问题:
(1)D的价电子的电子排布式是??;F原子的原子结构示意图为??。
(2)A、B的第一电离能的大小顺序为?。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为?(任写一个即可)。
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为?。

(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式?。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为?。
参考答案:(1)3d104s1?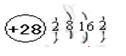
(2)N大于O
(3)sp2? CO2?
(4)12
(5)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H="-Q" kJ/mol
(5)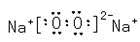 ?3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3
?3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3
本题解析:由题知,A的基态原子最外层电子排布式为2s22p3,A是N元素;B是地壳中含量最高的元素,B是O;C+与B的简单离子的电子层结构相同,C是Na;D的一种核素的质量数为64,中子数为35,D是Cu;E 、F既同周期又同族,则它们两是第四周期Ⅷ,且原子序数F比E多2,E、F分别是Fe、Ni。
(1)Cu的价电子除了4s上电子外,还包括3d上的电子;
(2)N的2p处于半充满状况,N第一电离能大于O;
(3)AB3-中N的孤电子对对数=(5+1-3×2)/2=0,即采取sp3,与N2O互为等电子体是CO2;
(4)同一个切面上的对角线顶点4个,共3个面,共12个。
本题难度:一般
3、选择题 元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈
D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
参考答案:C
本题解析:同一主族,随着原子序数递增,非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,气态氢化物的还原性逐渐增强,A项正确;同一周期从左到右元素非金属性逐渐增强,则B项正确;根据金属活动性顺序表知Ca比Na的金属性更强,所以和水反应更剧烈,C项错误。
本题难度:一般
4、选择题 下列轨道表示式能表示基态氮原子的核外电子排布的是(?)


A.
B.

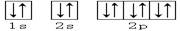
C.
D.
参考答案:A
本题解析:略
本题难度:简单
5、选择题 与OH-具有相同质子数和电子数的微粒
A.F-
B.NH3
C.H2O
D.Na+
参考答案:A
本题解析:OH-的质子数和电子数分别是9和10。选项A~D中的质子数和电子数分别为9和10、10和10、10和10、11和10.所以答案选A。
本题难度:简单