1、填空题 (第(1)小题每空1分,其余每空2分,共12分)
A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍。A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物。C+具有与氖原子相同核外电子排布。D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素分别是(写元素符号) A??B??C??D?
(2)用电子式写出A2B化合物的形成过程___; 用电子式写出C2B化合物的形成过程___;
(3)A2B2中加少量MnO2反应的化学方程式________;C2B2与CO2反应的化学方程_____。
参考答案:(1)H ?O ?Na ?Cl?(写名称不得分)
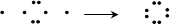 (2)? H? + ?O ?+ ?H? H? O? H ;?
(2)? H? + ?O ?+ ?H? H? O? H ;?
 ?
?

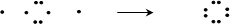 ? Na? +? O? +? Na?
? Na? +? O? +? Na?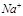 [? O? ]
[? O? ]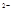
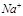 (未标电子转移方向可不扣分)
(未标电子转移方向可不扣分)
MnO2
本题解析:“B原子最外层电子数是最内层电子数的3倍”,则B的核外电子排布为2 6或2 8 6
再结合“A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物,C+具有与氖原子相同核外电子排布”,得:A是氢元素、B是氧元素、C是钠元素;D的核外电子排布为2 8 7,所以D为氯元素;
本题难度:简单
2、填空题 a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为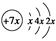 ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为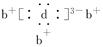 ,则下列叙述中正确的是
,则下列叙述中正确的是
( )。
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
参考答案:C
本题解析:根据核外电子排布规律知,x=2,a为Si,由b、d形成的化合物的电子式可知b为Na,d为N,c、d同主族,则c为P。原子序数:c>a>b,A错误;N2中含有N≡N键,性质很稳定,B错误;原子半径:a>c>d,C正确;最高价氧化物对应的水化物的酸性:d>c>a,D错误。
本题难度:一般
3、选择题 下列分散系中的分散质的粒子大小属于纳米级(1~100 nm)的是
A.Fe(OH)3胶体
B.Fe(OH)3沉淀
C.FeCl3溶液
D.碘与CCl4
参考答案:A
本题解析:试题分析:按照定义可知分散质的粒子大小属于纳米级(1~100 nm)的是A。
考点:分散系
点评:分散系是按照分散质粒子的直径进行分类的,小于1nm的为溶液,1-100nm之间的为胶体,大于100nm的为浊液。熟悉该定义此类问题便不难解决。
本题难度:困难
4、填空题 (11分) A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)D的元素符号?,E的最高价氧化物的水化物的分子式?。
(2)画出B元素的原子结构示意图?。
(3)若构成F元素的一种原子的质量数为35,写出其原子符号?,它原子核内的中子数是?。
(4)A与F、C与F、A与C元素最高价氧化物的水化物反应的离子方程式依次
为:?、?、?。
参考答案:(11分)(1)Si? H3PO4?(2)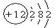
(3) ? 18
? 18
(4)H++OH- = H2O? Al(OH)3+3H+=Al3++3H2O? Al(OH)3+OH- = AlO2-+2H2O
本题解析:三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,说明一定含有铝元素。根据原子序数大小顺序可知,C是铝,A是第IA元素,所以F是氯元素。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性,因此A的相对原子质量是11.5÷0.5=23,所以A是钠元素,则B是Mg。D元素原子的最外层电子数比次外层电子数少4个,则D是硅。E元素原子的次外层电子数比最外层电子数多3个,则E是P。
本题难度:一般
5、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| R
| W
|
原子半径/pm
| 160
| 143
| 89
| 70
| 66
|
主要化合价
| +2
| +3
| +2
| +5、-3
| -2
|
?
下列叙述正确的是
A.X、Z元素的金属性:X < Z
B.气态氢化物的稳定性:R > W
C.Y的最高价氧化物既能溶于H2SO4又能溶于NaOH
D.一定条件下,R单质与常见的W单质能直接生成RW2
参考答案:C
本题解析:由题意知X为Mg,Y为Al,Z为Be,R为N,W为O,A、X与Z主要化合价相同,即在同族,元素的原子序数越大,金属性越高,X的原子半径大于Z,金属性X>Z,故A错误;B、R与W在同一周期,越往右酸性越强,W在R右边,氢化物的稳定性越强,即氢化物稳定性R<W,故B错误;C、Y为Al,氧化铝是两性氧化物,能溶于酸也能溶于碱,故C正确;D、氮气非常稳定,无法用其制取二氧化氮,故D错误。
本题难度:一般