1、选择题 下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C.Fe与稀硫酸反应制取氢气时,改用浓硫酸
D.用碳还原Fe2O3冶炼铁时,增大碳的用量
参考答案:A、因水为纯液体,则改变水的量对反应速率无影响,故A错误;
B、Zn置换出硫酸铜溶液中的Cu,与稀硫酸构成Cu、Zn原电池,从而加快反应速率,故B正确;
C、因浓硫酸具有强氧化性,Fe与浓硫酸反应不生成氢气,则不会加快生成氢气的速率,故C错误;
D、因C为纯固体,增大C的量对反应速率无影响,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 设C+CO2 2CO △H>0,反应速率为u1,N2+3H2
2CO △H>0,反应速率为u1,N2+3H2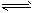 2NH3 △H<0反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3 △H<0反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
[? ]
A.同时增大
B.同时减小
C.增大,减小
D.减小,增大
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列措施中,能减慢化学反应速率的是
A.食物储存在冰箱里
B.将块状固体药品研细后再反应
C.用MnO2作H2O2分解反应的催化剂
D.用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应
参考答案:A
本题解析:A中食物储存在冰箱里,温度低,反应速率降低,A正确;B中将块状固体药品研细后再反应,增大反应物的接触面积,反应速率增大,B不正确;C中催化剂加快反应速率,C不正确;D中增大反应物氢离子的浓度,反应速率加快,D不正确,答案选A。
点评:该题是基础性试题的考查,也是高考中的常见考点。明确反应速率的含义和外界条件对反应速率的影响规律是答题的关键,难度不大。
本题难度:一般
4、计算题 二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡(NO2浓度约为
0.0125mol·L-1)。下图中的曲线表示二氧化氮分解反应在前20s内的反应进程。

(1)请计算前25s内氧气的平均生成速度。
(2)若反应延续至70s,请在上图中用实线画出25s至70s的反应进程曲线。
(3)若反应开始时加入催化剂(其他条件都不变)请在图上用虚线画出加入催化剂后的反应进程曲线。
参考答案:(1)5.5×10-4mol·L-1·s-1
(2)下图中实线
(3)下图中虚线 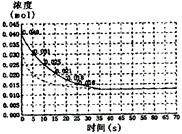
本题解析:
本题难度:一般
5、填空题 (10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。
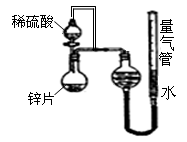
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
序号
| Ⅴ(H2SO4)/mL
| C(H2SO4)/mol·L-1
| t/s
|
Ⅰ
| 10
| 1
| t1
|
Ⅱ
| 10
| 3
| t2
|
?
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨? b.银? c.铜? d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
参考答案:(每空2分) (1)Zn+2H+=Zn2++H2↑
(2)其他条件不变时,浓度越大,反应速率越快。
(3)无影响
(4)abc
(5)升高温度、将锌片换成锌粒或锌粉(任答一种给分,其他合理答案也给分)
本题解析:(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑;②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平。(3)根据所给装置可以看出实验中向烧瓶中滴入的稀硫酸的体积对测定气体体积无影响;(4)由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是石墨、银、铜等;(5)加快该反应的反应速率还可以升高温度、将锌片换成锌粒或锌粉等。
本题难度:简单