1、选择题 将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是(?)
①20ml0.01mol∕LKCl溶液;②20ml0.02mol∕LCaCl2溶液;③20ml蒸馏水;
④20ml0.03mol∕LHCl溶液;⑤20ml0.05mol∕L AgNO3溶液;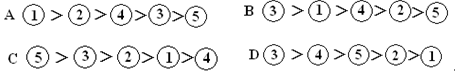
参考答案:B
本题解析:加入氯离子或银离子是氯化银的沉淀溶解平衡向逆向移动。故只需比较氯离子或银离子浓度,浓度越大,溶解度越小。故答案B正确。
本题难度:一般
2、选择题 下列说法不正确的是
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
参考答案:D
本题解析:对于在一定条件下的一种难溶性的物质来说,当其在水溶液中达到沉淀溶解平衡时,各种离子浓度幂指数乘积是一个常数,这个常数就叫做该物质的溶度积常数。由于物质的溶解度受温度的影响,所以Ksp除了与难溶电解质的性质有关外,还收温度的影响。因此正确。B.ZnS、CuS化学式的组成相似,Ksp(ZnS)>Ksp(CuS),说明ZnS的溶解度比CuS大。当ZnS达到沉淀溶解平衡后,向其水溶液中加入含Cu2+的溶液,ZnS电离产生的S2-会与Cu2+结合产生溶解度更小的CuS沉淀。由于消耗了S2-。破坏了ZnS的沉淀溶解平衡,ZnS继续溶解、电离,产生的S2-再反应产生CuS沉淀。经过一定的时间,ZnS逐渐转变为CuS沉淀。沉淀的颜色由白色转变为黑色。因此ZnS在一定条件下可转化为CuS沉淀。正确。C.对于一个确定的物质来说,其溶度积常数Ksp只与温度有关而与离子的浓度无关。正确。D.溶度积常数是物质达到沉淀溶解平衡时,电离产生的各种离子浓度幂指数的乘积。两种难溶电解质若其形成的化合物阴阳离子的个数比相同(即结构相似)时,Ksp小的,溶解度一定小,但若结构不相似,Ksp小的,溶解度可能大。错误。
本题难度:一般
3、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
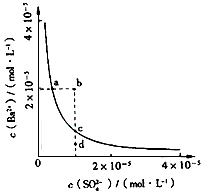
[? ]
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:
本题难度:一般
4、选择题 将100mL0.1mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435g沉淀,则下列说法正确的是(?)
A.产生的沉淀是AgCl
B.产生的沉淀是AgF
C.产生的沉淀是AgCl和AgF
D.AgF溶于水
参考答案:AD
本题解析:由AgNO3?+? NaCl = NaNO3+? AgCl↓
0.01mol? 0.01mol? 0.01mol
所以m(AgCl)=0.01mol×143.5g/mol=1.435g
故沉淀为AgCl,AgF溶于水。
本题难度:一般
5、选择题 已知AgCl的溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq)下列说法不正确的是( )
A.除去溶液中Ag+加盐酸盐比硫酸盐好
B.加入H20,溶解平衡不移动
C.用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
D.反应2AgCl+Na2S═Ag2S+2NaCl说明溶解度:AgCl>Ag2S
参考答案:A、氯化银溶解度小于硫酸银,除去溶液中Ag+加盐酸盐比硫酸盐好,故A正确;
B、加入H20,沉淀溶解平衡正向进行,故B错误;
C、用NaCl溶液代替蒸馏水洗涤AgCl,氯化钠溶液中氯离子抑制程度溶解平衡,平衡左移,可以减少沉淀损失,故C正确;
D、反应2AgCl+Na2S═Ag2S+2NaCl,反应向更难溶的方向进行,说明溶解度:AgCl>Ag2S,故D正确;
故选B.
本题解析:
本题难度:一般