1、实验题 (16分)实验中需要230mL0.1mol/LNa2CO 3溶液,回答下列问题
3溶液,回答下列问题
(1) 配制溶液时应选用容量瓶的规格_______?
(2) 若用托盘天平称量,实际应称碳酸钠的质量_______?
(3)用已称好的Na2 CO3固体配制溶液,除容量瓶外还需要的其他仪器
CO3固体配制溶液,除容量瓶外还需要的其他仪器
______??、?_ 、 _____________
(4)配制时,其正确的操作顺序为 (字母表示,每个字母只用一次)
______?______________
A.用少量蒸馏水冲洗 2~3 次,将冲洗液移入容量瓶中[
B.将称好的碳酸钠钠固体放入烧杯中,加适量蒸馏水将其溶解
C.将冷却后的碳酸钠溶液转移至容量瓶中
D.最后盖好瓶盖,振荡摇匀
E.改用胶头滴管小心地加水至溶液凹液面与刻度线相切。
F.向容量瓶内加水至刻度线 1~2 cm 处
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是无影响?
A、加水时越过刻度线? _________?
B、定容时俯视刻度线? __________
C、容量瓶内壁附有水珠而未干燥处理? ______?
D、固体溶解后没有冷却便进行定容? _____?
参考答案:(16分)
(1)250ml (2分)?(2)2.7g?(3分)
(3)烧杯、玻璃棒、胶头滴管?(3分)
(4)BCAFED?(4分)
(5)A、偏低? B、偏高? C 、无影响? D、偏高(每空1分)
、无影响? D、偏高(每空1分)
本题解析:略
本题难度:一般
2、实验题 (14分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用右图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)
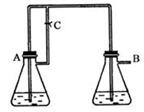
(1)则锥形瓶A中应加入的药品为_________________.(2分)
(2)锥形瓶B中应加入的药品为__________________.(2分)
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
①_____________________?②_______________________________。(4分)
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:?
?;(2分)
请写出此时B瓶中发生的化学反应的离子方程式:?
?;(4分)
参考答案:(1)铁和稀硫酸;(2分)?(2)氢氧化钠溶液。(2分)
(3)?①打开弹簧夹C;(2分)②反应一段时间后关闭弹簧夹C;(2分);
(4)A中液体被压入到B瓶,(1分);B瓶内生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色;(1分)
Fe2++2OH--=Fe(OH)2(2分);4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
本题解析:略
本题难度:简单
3、填空题 (15分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为________(填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是_____________________________________________________________________。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是
 __________________________________________________
__________________________________________________ ______________________。
______________________。
Ⅱ.标定FeSO4溶液的浓度
( 1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______?__,据此可测得FeSO4溶液的物质的量浓度为______?__mol·L-1。
1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______?__,据此可测得FeSO4溶液的物质的量浓度为______?__mol·L-1。
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,理由是____________________________________________________________________。
参考答案:Ⅰ.(1)A→B→C→E→D(2分)
(2)①防止Fe2+、Fe3+水解(2分)
②将药品中Fe3+还原并防止Fe2+被氧化(2分)
Ⅱ.(1)5Fe2++8H++MnO4-===5Fe3++Mn2++4H2O(3分) 0.50(2分)
(2)C(2分)可利用KMnO4溶液紫色不再褪去判断滴定终点(2分)
本题解析:略
本题难度:一般
4、实验题 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用于消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表

参考答案:
本题解析:
本题难度:一般
5、实验题 某校学生活动小组设计如图所示装置探究工业制硫酸接触室中反应产物,并测定此条件下二氧化硫的转化率。实验时,装置D锥形瓶中溶液产生白色沉淀,装置E中溶液褪色。
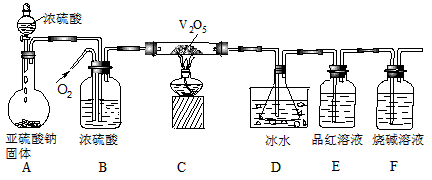
(1)装置B的三个作用是①______________;②______________;③______________。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是____________________________。
(3)D中锥形瓶盛放的溶液可以是(选填序号)__________。
① 少量澄清石灰水 ②少量小苏打溶液 ③少量氯化钡溶液 ④少量硝酸钡溶液
反应停止后,要通过装置D锥形瓶中产生的白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程)___________________________。
(4)若从锥形瓶溶液中得到的沉淀质量为m g,要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是(选填序号)______________,二氧化硫的转化率是______________(用含有m、a、b、c、d中的一种或几种字母的代数式表示)。
① 装置F增加的质量a g ② 装置A中亚硫酸钠减少的质量b g
③ 装置B增加的质量c g ④ 装置E增加的质量d g
参考答案:(1)①干燥氧气和二氧化硫;②使氧气和二氧化硫混合均匀;③便于通过观察气泡的速率,控制氧气和二氧化硫的比例
(2)该反应的正反应放热,温度过高平衡逆向移动,不利于三氧化硫的生成;且影响催化剂的活性
(3)③;向锥形瓶中滴加氯化钡溶液,直至沉淀量不再增加。(或“静置后向上层清液中滴入氯化钡溶液,若产生沉淀,继续加入氯化钡溶液,重复上述过程至清液中不再产生沉淀)
(4)①④;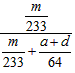 ×100%
×100%
本题解析:
本题难度:困难