1、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO4?5H2O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO4?5H2O.
故反应方程式为第一步:2Cu+O2?△?.?2CuO;
第二步:CuO+H2SO4=CuSO4+H2O;
第三步:CuSO4+5H2O=CuSO4?5H2O.
故答案为:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O;CuSO4+5H2O=CuSO4?5H2O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
故答案为:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
本题解析:
本题难度:一般
2、填空题 碘是人体必需的微量元素之一,有“智力元素”之称.食用加碘食盐可预防碘缺乏病.查阅资料知:①在酸性条件下,I-能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2.
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种.
限选试剂如下:1.0mol?L-1HNO3溶液、1.0mol?L-1?H2SO4溶液、1.0mol?L-1NaHSO3溶液、3%?H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;?假设2:该食盐样品中含I-
假设3:______.
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 | 预期现象与结论
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡.
若溶液显______,则假设1成立;否则,假设1不成立,再进行步骤2
步骤2:______
______
______
若溶液显蓝色,则假设2成立,反应的离子方程式为______;否则,假设2不成立,再进行步骤3
步骤3:______
______
______
______
______
|
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源.从化学角度来看,试验中添加______(填“KIO3”或“KI”)更好;理由是______.
参考答案:Ⅰ根据实验目的确定知,另一种实验假设为假设食盐中含有IO3-,故答案为:假设食盐中含有IO3-;
Ⅱ食盐样品中所加碘的存在形式是I2、I-、IO3-中的一种,
步骤1 先用淀粉溶液检验食盐样品中是否有碘单质,如果有碘单质,向食盐样品溶液中加入淀粉溶液,溶液会变蓝色,则假设1成立;否则,假设1不成立;
步骤2? 假设样品溶液中含有碘离子,因为碘离子有还原性,向溶液中加入稀硫酸和几滴双氧水,双氧水有氧化性能把碘离子氧化生成碘单质,再用淀粉溶液检验是否含有碘,若溶液显蓝色,则假设2成立,否则,假设2不成立;
步骤3 假设样品溶液中含有碘酸根离子,因为碘酸根离子有氧化性,向溶液中加入亚硫酸氢钠,亚硫酸氢钠有还原性,能把碘酸根离子还原成碘单质,再用淀粉溶液检验是否含有碘,若溶液显蓝色,则假设3成立,否则,假设3不成立;
故答案为:步骤1:蓝色;
步骤2:取少量上述溶液注入试管中,滴入几滴1.0mol?L-1H2SO4溶液和几滴3%H2O2溶液,再滴入几滴淀粉溶液,振荡;2I-+H2O2+2H+=I2+2H2O;
步骤3:取少量上述溶液注入试管中,滴入几滴1.0mol?L-1NaHSO3溶液,再滴入几滴淀粉溶液,振荡;若溶液呈蓝色,则假设3成立,否则,假设3不成立;
III 碘酸钾较稳定,在空气中不易被还原,碘化钾不稳定,在空气中易失去电子被氧气氧化生成碘单质,碘易升华,所以如果食盐中加入碘化钾,易失效,所以食盐中加碘酸钾,
故答案为:KIO3;碘化钾易被空气中氧气氧化生成碘.
本题解析:
本题难度:一般
3、实验题 (12分)目前市场销售的某种食用精制盐包装袋上有如下说明:
产品标准
| GB5461
|
产品等级
| 一级
|
配料
| 食盐、碘酸钾、抗结剂
|
碘含量(以I计)
| 20~50mg/kg
|
分装日期
| ?
|
分装企业
| ?
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
?KIO3+?KI+?H2SO4=?K2SO4+?I2+?H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是?。
②某学生设计回收四氯化碳的操作步骤为:
a?将碘的四氯化碳溶液置于分液漏斗中;
b?加入适量;
c?分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是?。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a?准确称取wg食盐,加适量蒸馏水使其完全溶解;
b?用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c?以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol·L-1的Na2S2O3溶液24.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是?。
②b中反应所产生的I2的物质的量是?mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)?mg/kg。
参考答案:(1)1、5、3、3、3、3
(2)①I2+SO32-+H2O=2I-+SO42-+2H+?②在步骤b后,增加操作:将分液漏斗充分振荡后静置
(3)①溶液由蓝色恰好变为无色?②1.2×10-5?③5.08×102/w ?或508/w
本题解析:(1)根据化合价升降法配平方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)①Na2SO3溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+。
②回收CCl4的时候,加入Na2SO3溶液后,要振荡静置,然后才能分液,所以在步骤b后,增加操作:将分液漏斗充分振荡后静置。
(3)①以淀粉做指示剂的时候,当I2反应完后,恰好完全反应,所以溶液由蓝色变为无色。
②反应后生成I2的物质的量为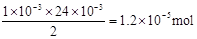 。
。
精制盐的含碘量为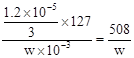
点评:本题很基础,主要考查学生的计算能力和分析问题的能力。
本题难度:一般
4、选择题 将下列选项中的两种气体X和Y同时通入盛有足量氯化钡溶液的洗气瓶中(如右图装置),肯定无沉淀产生的是(?)
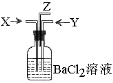
A.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y
B.碳跟浓硫酸共热产生的气体X和铜跟稀硝酸反应产生的气体Y
C.MnO2跟浓盐酸共热产生的气体X和碳跟浓硫酸共热产生的气体Y
D.碳跟浓硫酸共热产生的气体X和NH4Cl与Ca(OH)2共热产生的气体Y
参考答案:B
本题解析:碳与浓硫酸共热产生的气体有CO2和SO2,铜与浓硝酸反应产生的气体是NO2,3NO2+H2O=2HNO3+NO ,SO2在HNO3的氧化下生成H2SO4,故A项肯定有生成沉淀。
铜与稀硝酸反应产生的气体是NO,NO不与水发生反应,故B肯定无沉淀产生,答案选B。
C项中MnO2跟浓盐酸共热产生的气体X为Cl2,Cl2+SO2+2H2O=2HCl+H2SO4,故C有沉淀产生。
D项中气体Y为NH3,,SO2+2NH3+H2O=(NH4)2SO3 ,SO3+Ba2+=BaSO3故D不能选。
点评:本题考查化学实验,物质化学反应问题,,应注意加强积累。
本题难度:简单
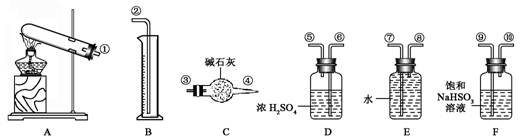
5、实验题 (17分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:
【提出猜想】
Ⅰ.所得气体的成分可能只含?一种;
Ⅱ.所得气体的成分可能含有?二种;
Ⅲ.所得气体的成分可能含有??三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__?(填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想??正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:?
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
实验小组
| 称取CuSO4
的质量(g)
| 装置C增加
的质量(g)
| 量筒中水的体积折算成标
准状况下气体的体积(mL)
|
一
| 6.4
| 2.56
| 298.7
|
二
| 6.4
| 2.56
| 448
|
?
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________??;
二组:_??。?
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
参考答案:
【提出猜想】 Ⅰ.SO3?Ⅱ.SO2、O2?Ⅲ.SO3、SO2、O2(各1分)
【实验探究】(1)①⑨⑩⑥⑤③④⑧⑦②?(2分)
(2) Ⅰ?(1分)
(3)不能(1分),因为SO3与F中的饱和NaHSO3反应会生成等物质的量的SO2?(2分)
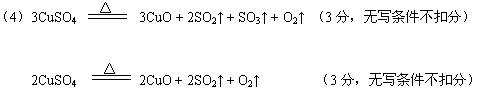
(5)B (1分)? E(1分)
本题解析:略
本题难度:简单