1、选择题 下列关于原电池的叙述中错误的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
参考答案:A、构成原电池的正极和负极可能是两种不同的金属,也可能是导电的非金属(如石墨棒)和金属,故A错误.
B、原电池是将化学能转变为电能的装置,故B正确.
C、在原电池中,负极上失去电子发生氧化反应,正极上得电子发生还原反应,所以电子从负极沿导线流向正极,故C正确.
D、原电池放电时,电子从负极沿导线流向正极,电流的方向是从正极到负极,故D正确.
故选A.
本题解析:
本题难度:一般
2、选择题 下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
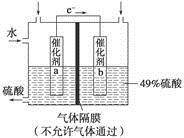
A.该装置将化学能转化为电能
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15
参考答案:B
本题解析:该装置为原电池
负极(a)2SO2-4e-+4H2O===8H++2SO42-
正极(b)O2+4e-+4H+===2H2O,A项正确;
B项,酸性应减弱,错误;C项正确;D项,2SO2+O2+2H2O===2H2SO4,
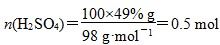
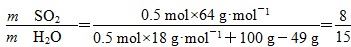
正确。
本题难度:一般
3、选择题 如图是一套电化学装置,对其有关说法错误的是( )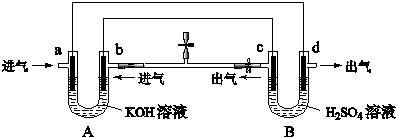
A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液PH增大
C.a口若消耗1molCH4,d口可产生4mol气体
D.a口通入C2H6时的电极反应为C2H6-14e-+18OH-═2CO32-+12H2O
参考答案:A.由装置图可知A消耗气体,应为燃料电池装置,则B生成气体,为电解池装置,故A正确;
B.电解硫酸溶液时,阳极发生氧化反应生成氧气,阴极发生还原反应生成氢气,实质为电解水,硫酸浓度增大,pH减小,故B错误;
C.由元素化合价可知,a口若消耗1mol CH4,应生成碳酸钾,则失去电子8mol,为原电池的负极,则d为阴极,生成氢气,应为4mol,故C正确;
D.a口通入C2H6时,乙烷被氧化生成碳酸钾,电极反应为C2H6-14e-+18OH-═2CO32-+12H2O,故D正确.
故选B.
本题解析:
本题难度:一般
4、选择题 对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是(? )
A.以石墨为电极,电解含甲基橙的0.1 mol·L-1硫酸溶液
B.以铜为电极,电解1 mol·L-1硫酸溶液
C.以石墨为电极,电解含酚酞的饱和食盐水
D.以石墨为电极,电解1 mol·L-1溴化钾溶液
参考答案:A
本题解析:A中原溶液呈红色,通电一段时间后,溶液中c(H+)会增大,酸性增强,但溶液颜色不变,仍为红色。B中阳极Cu溶解,形成Cu2+进入溶液,故通电一段时间后溶液会由无色变成蓝色。C中原溶液呈无色,通电一段时间后,由于溶液中c(OH-)增大,碱性增强,故溶液会由无色变为红色。D中由于Br-在阳极放电,2Br--2e-====Br2,故溶液会由无色变为橙色。
本题难度:一般
5、计算题 将甲、乙两铂片插入200 g 10% CuSO4溶液中进行电解,当阳极析出0.16 g气体时,求:
(1)阴极析出多少克铜?剩余CuSO4溶液中溶质的质量分数是多少?
(2)需要多少电荷量?
参考答案:(1)0.64 g;9.3 %
(2)1.93×103 C
本题解析:(1)这是一道化学与物理综合的试题,涉及的知识点有电化学、电学。电解的化学方程式为:
2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
其中阳极放出O2,阴极生成Cu,设反应中生成Cu和消耗CuSO4的质量分别为x、y。
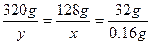
解得x="0.64" g,y="1.6" g。
w(CuSO4)=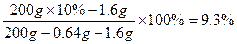 。
。
(2)由化学方程式中元素化合价变化可知:每生成1 mol O2时,转移4 mol e-,所以反应中通过的电荷量为:
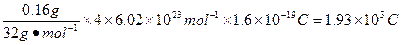 。
。
本题难度:简单