1、计算题 “温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
|
?
① 实验1条件下平衡常数K=?(保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值?(填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正)?v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为?。
(3)已知BaSO4(s) + 4C(s) ="4CO(g)" + BaS(s)?△H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s)?△H2="+226.2" kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3=?kJ/mol。
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li ?LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:??和?。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为?。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li ?LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:??和?。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为?。(Li的相对原子质量约为7.0)
参考答案:(16分)
(1)①2.67(2分)?②<1 (2分)?③< (2分)
(2)5.6×10—5mo1/L (2分)
(3)+172.5 (2分)
(4)FePO4+Li++e—=LiFePO4(2分)? Li-e—=Li+(2分)? 1.4 g(2分)
本题解析:(1)①表中实验1有关组分的起始物质的量、平衡物质的量已知,容器体积为2L,由于c=n/V,则
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 2? 1? 0? 0
变化浓度(mol/L)? 0.8? 0.8? 0.8? 0.8
平衡浓度(mol/L)? 1.2? 0.2? 0.8? 0.8
K=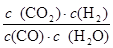 =
= =2.67
=2.67
②实验3中CO、H2O的起始浓度分别为a/2mol/L、b/2mol/L,设CO的变化浓度为xmol/L,由于CO、H2O的变化浓度之比等于化学方程式的系数之比,则H2O的变化浓度为xmol/L,则CO、H2O的平衡转化率分别为2x/a、2x/b,若CO的平衡转化率大于水蒸气,则2x/a>2x/b,所以a/b<1;
③先根据实验2中有关数据求900时的平衡常数,再根据温度不变平衡常数不变,利用此时各组分的物质的量计算各自浓度,根据浓度商与平衡常数的大小判断此时反应进行的方向(若浓度商大于平衡常数,则反应向逆反应方向进行,反之,则向正反应方向进行),最后反应向哪个方向进行,则哪个方向的速率就大于相反方向的速率。
表中实验2有关组分的起始物质的量、平衡物质的量已知,容器体积为2L,由于c=n/V,则
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 1? 0.5? 0? 0
变化浓度(mol/L)? 0.2? 0.2? 0.2? 0.2
平衡浓度(mol/L)? 0.8? 0.3? 0.2? 0.2
K=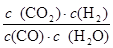 =
= =0.167
=0.167
实验4时CO、H2O、CO2、H2的浓度分别为5mol/L、2.5mol/L、1mol/L、2.5mol/L,则Q=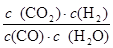 =
= =0.2>K=0.167,说明此时反应应该向逆反应方向进行,所以v(逆)>v(正),即v(正)<v(逆);
=0.2>K=0.167,说明此时反应应该向逆反应方向进行,所以v(逆)>v(正),即v(正)<v(逆);
(2)设混合前CaCl2溶液的最小浓度为xmol/L,Na2CO3溶液的浓度为2×10—4mo1/L,则等体积混合后CaCl2、Na2CO3的浓度分别为x/2mol/L、1×10—4mo1/L,则Ksp=2.8×10—9= x/2×1×10—4,x=5.6×10—5;
(3)先将3个热化学方程式依次编号为①②③,接着观察它们的关系,发现①/2—②/2=③,则C(s) + CO2(g) = 2CO(g)的△H3=△H1 /2—△H2/2="+172.5" kJ/mol;
(4)放电时电池总反应式为FePO4+Li=LiFePO4,其中锂元素由0升为+1价,铁元素由+3降为+2价,前者在负极上发生氧化反应,后者在正极上发生还原反应,根据电子、电荷、原子守恒原理及电解质中定向移动的离子环境,正极反应式为FePO4+Li++e—=LiFePO4,负极反应式为Li-e—=Li+;用惰性电极电解水的原理为2H2O 2H2↑+O2↑~4e—,则n(H2)=2n(O2),由于n=V/Vm,则n(H2)+n(O2)="3" n(O2)=3.36L÷22.4L/mol=0.15mol,则n(O2)=0.05mol,则转移电子的物质的量="4" n(O2)=0.2mol,由于新型电池中转移电子和电解水时转移电子相等,FePO4+Li=LiFePO4~e—中参加反应的锂与转移电子的系数之比等于物质的量之比,则参加反应的锂为为0.2mol,由于锂的相对原子质量约为7.0,m=n×M,则参加反应的锂为1.4g。
2H2↑+O2↑~4e—,则n(H2)=2n(O2),由于n=V/Vm,则n(H2)+n(O2)="3" n(O2)=3.36L÷22.4L/mol=0.15mol,则n(O2)=0.05mol,则转移电子的物质的量="4" n(O2)=0.2mol,由于新型电池中转移电子和电解水时转移电子相等,FePO4+Li=LiFePO4~e—中参加反应的锂与转移电子的系数之比等于物质的量之比,则参加反应的锂为为0.2mol,由于锂的相对原子质量约为7.0,m=n×M,则参加反应的锂为1.4g。
本题难度:一般
2、选择题 在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
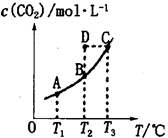
A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
参考答案:A
本题解析:A、分析图像知,温度越高平衡时c(CO2)越大,平衡正向移动,CO浓度减小,所以A点CO浓度大,错误;B、T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行,则一定有υ(正)<υ(逆),正确;C、分析图像可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故正反应是吸热反应,即△H>0,正确; D、该反应正反应是吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,则K1<K2,正确。
本题难度:一般
3、选择题 某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
[? ]
A.a=1
B.a=2
C.B的转化率为40%
D.B的转化率为60%
参考答案:AC
本题解析:
本题难度:一般
4、选择题 已知A(s)+2B(g)  2C(g)+D(g)?△H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
2C(g)+D(g)?△H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
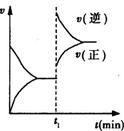
A.t1时,一定是升高了反应的温度
B.t1时,可能是向容器中通入了一定量的C气体
C.t1时,可能是向容器中加入了催化剂
D.t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变
参考答案:D
本题解析:A、A(s)+2B(g)  2C(g)+D(g)?△H<0,是放热反应,升高温度,平衡逆向移动,本反应又是气体体积减小的反应,加压后,平衡也逆向移动,A有两种可能,升高温度,增大压强,A错误;B、通入一定量的C气体,正速率应从原平衡开始变大,B错误;C、向容器中加入催化剂,正逆反应速度均增大,且变化量相同,C不正确;D、如是升高温度,平衡逆向移动,平衡常数变小,如是加压后,平衡也逆向移动,平衡常数不变,D正确,选D。
2C(g)+D(g)?△H<0,是放热反应,升高温度,平衡逆向移动,本反应又是气体体积减小的反应,加压后,平衡也逆向移动,A有两种可能,升高温度,增大压强,A错误;B、通入一定量的C气体,正速率应从原平衡开始变大,B错误;C、向容器中加入催化剂,正逆反应速度均增大,且变化量相同,C不正确;D、如是升高温度,平衡逆向移动,平衡常数变小,如是加压后,平衡也逆向移动,平衡常数不变,D正确,选D。
本题难度:一般
5、选择题 已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:
2CO2(g)+6H2(g) ?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
A.升高温度,该反应的平衡常数将增大
B.再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C.加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D.T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分