1、选择题 下列元素属于碳族元素的是
A.F
B.Si
C.Fe
D.P
参考答案:B
本题解析:碳族元素包括:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb);
F属于VIIA族;Fe属于VIII族;P属于VA族;
本题难度:一般
2、选择题 将过量的CO2分别通入:①CaCl2溶液;②Na2SiO3溶液;③Ca(ClO)2溶液;④Ca(OH)2溶液,最终有沉淀析出的是
A.①②③④
B.②
C.①③④
D.②③④
参考答案:B
本题解析:CO2与氯化钙溶液不反应,与硅酸钠溶液反应生成硅酸白色沉淀,与次氯酸钙反应生成白色沉淀碳酸钙,CO2过量白色沉淀又溶解生成碳酸氢钙;与氢氧化钙反应生成白色沉淀碳酸钙,CO2过量白色沉淀又溶解生成碳酸氢钙,所以正确的答案选B。2与盐以及碱反应产物的判断
本题难度:简单
3、选择题 Al2O3·2SiO2·2H2O是?
A.混合物
B.两种氧化物的水化物
C.硅酸盐
D.铝酸盐
参考答案:C
本题解析:硅酸盐虽可用氧化物形式表示但并不是氧化物。
本题难度:简单
4、填空题 2010年5月15日,CCTV对“南澳一号”沉船的考古进行了两个小时的现场直播,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。
青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x],可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右一次烧成的釉可形成精美的青花瓷。
(1)下列说法正确的是________(填序号)。
A.高岭土分子中x=2
B.钾长石能完全溶解在盐酸中形成澄清的溶液
C.烧制青花瓷过程中发生了复杂的物理变化和化学变化
D.青花瓷、玻璃、水泥都属于硅酸盐产品
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程:
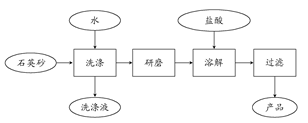
①洗涤石英砂的目的是___________________________________。
②二氧化硅与氢氧化钠溶液反应的离子方程式是______________________
③在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________。
④工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1。下列说法正确的是________(填序号)。
A.SiC性质稳定,能用于制造抗高温水泥
B.制造粗硅时的反应为:2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
C.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
D.纯净的SiO2只能用于制造光导纤维
参考答案:(1)CD (2)①除去石英砂中的NaCl杂质 ②SiO2+2OH-=SiO32-+H2O ③增大反应物之间的接触面积,增大反应速率,提高生产效率 ④B
本题解析:(1)选项A,根据化合价代数和等于零的原则,可得:6+8-10-x=0,解得x=4。选项B,将KAlSi3O8改写为氧化物的形式为K2O·Al2O3·6SiO2,SiO2不能与盐酸反应,所以钾长石与盐酸反应后不能形成澄清的溶液。选项C,根据水泥制造过程可推测出烧制青花瓷过程中发生了复杂的物理变化和化学变化。选项D,青花瓷、玻璃、水泥符合硅酸盐产品的特点,是硅酸盐产品。
(2)①石英砂中含有易溶于水的NaCl杂质,洗涤石英砂可使NaCl与SiO2分离。②SiO2与NaOH溶液反应生成Na2SiO3和H2O,据此可写出相应的离子方程式。③将纯净的石英砂研磨后能增大物质的表面积,从而增大SiO2与NaOH的接触面积,增大反应速率,提高生产效率。④选项A,根据SiC中元素的价态可知,SiC具有还原性,在高温下仍能在O2中燃烧生成SiO2和CO2,因此不能用于制造抗高温水泥。选项B,粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1,根据原子守恒,可将题述信息转化为如下反应:2SiO2+5C=Si+SiC+4CO↑。选项C,因SiO2、Al2O3都能溶解在NaOH溶液中,无法实现二者的分离。选项D,纯净的SiO2还可用于制造光学玻璃等。
本题难度:一般
5、选择题 工业上由SiCl4制备高纯硅时,不使用钠、镁等活泼金属做还原剂,而是用氢气作还原剂其原因是
A.钠或镁等活泼金属的价格昂贵,成本高
B.钠或镁等活泼金属的还原性不及氢气强
C.钠或镁等金属可能与硅形成合金或残留在硅中
D.钠或镁的熔点没有硅高
参考答案:C
本题解析:略
本题难度:一般