1、选择题 下列物质不能与二氧化硅发生化学反应的是
A.CaO
B.氢氟酸
C.NaOH溶液
D.浓硫酸
参考答案:D
本题解析:略
本题难度:一般
2、计算题 在25 ℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中V(CO)________=L,V(H2)=______L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则原a的取值范围是________。
参考答案:(1)5? 5? (2)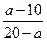 ?(3)10<a<20
?(3)10<a<20
本题解析:(1)设混合气中CO为x L。
2CO+O2 2CO2?减少1
2CO2?减少1
X?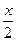
2H2+O2 2H2O(l)?减少3
2H2O(l)?减少3
(10-x)? (10-x)
(10-x)
因为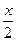 +
+ ?(10-x)=(10+15)-15,
?(10-x)=(10+15)-15,
解得x="5L?" 10-x="5" L
(2)同理下列方程式: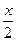 +
+ ?(10-x)=(10+15)-a
?(10-x)=(10+15)-a
解得:x="a-10L?" 10-x=(20-a)L
所以V(CO)∶V(H2)= 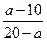
(3)因为
所以10<a<20
本题难度:简单
3、计算题 为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O2-4+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4 +CaSO4,再用蒸馏水稀释溶液至V0 mL。取出V1 mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:
2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
若滴定终点时消耗a mol/L的KMnO4 V2 mL,计算样品中CaCO3的质量分数。
参考答案: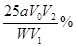
本题解析:分析:本题涉及到化学方程式或离子方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑? C2O2-4+Ca2+=CaC2O4↓
CaC2O4+H2SO4=H2C2O4+CaSO4?2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
由方程式可以得出相应的关系式:
5CaCO3——5Ca2+——5CaC2O4——5H2C2O4——2MnO-4
5?2
n1(CaCO3)? aV2×10-3 mol
n1(CaCO3) =" 2.5" aV2×10-3 mol
样品中:n(CaCO3) =? 2.5 aV2×10-3×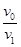 ?mol
?mol
则:ω(CaCO3) =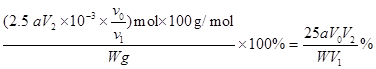
本题难度:一般
4、填空题 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为?。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为?。
(3)工业上可以通过如下图所示的流程制取纯硅:
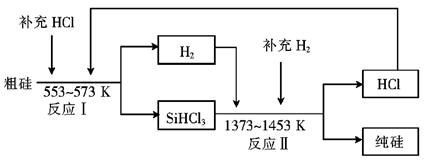
①若反应I为? Si(粗)+3HCl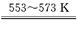 SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为?。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式:?。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是?。
参考答案:(1)第三周期IVA族?(2)1:2
(3)①SiHCl3+H2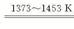 ?Si(纯)+3HCl?
?Si(纯)+3HCl?
②SiHCl3+3H2O = H2SiO3+3HCl+H2↑
③5:1
本题解析:(1)硅在周期表中位于第三周期第IVA族。
(2)将两方程式叠加,可知C和SiO2的物质的量之比为5:2,因此质量比为:(5×12):(2×60)=1:2。
(3)①由流程图可知反应II是SiHCl3和H2反应生成纯硅和HCl,因此方程式为:SiHCl3+H2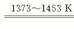 ?Si(纯)+3HCl。
?Si(纯)+3HCl。
②写出方程式中已知物质:SiHCl3+3H2O — H2SiO3+3HCl,由原子守恒可知另一种物质为H2,故方程式为SiHCl3+3H2O = H2SiO3+3HCl+H2↑。
③由题中条件可知:
Si(粗)+ 3HCl?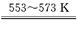 ?SiHCl3 + H2
?SiHCl3 + H2
1mol? 3mol? 1mol
SiHCl3+H2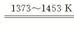 ?Si(纯)+3HCl
?Si(纯)+3HCl
1mol? 1mol? 3mol
由以上数据,循环生产中只能产生3molHCl,但HCl的利用率是90%,因此需要增加(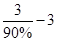 )molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(
)molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(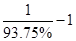 )molH2,因此,补充投入HCl 和H2的物质的量之比为:(
)molH2,因此,补充投入HCl 和H2的物质的量之比为:(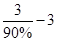 ):(
):(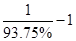 )=5:1。
)=5:1。
本题难度:一般
5、选择题 上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构(见下图),化学式为C60。下列说法中正确的是
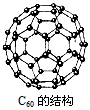
[? ]
A.C60是一种新型的化合物
B.C60中含有离子键
C.C60和金刚石、石墨都是碳元素的不同单质
D.C60的摩尔质量为720
参考答案:C
本题解析:
本题难度:简单