1、选择题 将CO2转化成有机物可有效实现碳循环。下列反应中,最节能的是
A.CO2 + 3H2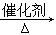 CH3OH +H2O
CH3OH +H2O
B.6CO2 + 6H2O C6H12O6 + 6O2
C6H12O6 + 6O2
C.CO2 + CH4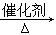 CH3COOH
CH3COOH
D.2CO2 + 6H2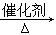 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
参考答案:B
本题解析:光合作用是自然界中碳循环的反应,不需要再人为提供能源,所以是最好、最节能的,因此答案选B。
本题难度:简单
2、实验题 实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A??B?
(2)实验步骤:
连接仪器、?、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是?;装置E中足量酸性KMnO4溶液的作用是?;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是?;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性?(填“能”或“否”),试管D中发生反应的离子方程式是?
参考答案:(1)A:分液漏斗B:圆底烧瓶
(2)检查装置的气密性
(3)①Cu+2H2SO4(浓) CuSO4+ SO2↑+2H2O?除去SO2气体
CuSO4+ SO2↑+2H2O?除去SO2气体
②盛有Na2SiO3溶液的试管中出现白色沉淀
③ 否 SO2+2HCO3-=SO32-+ H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑
本题解析:(1)A : 分液漏斗B:圆底烧瓶 .(2)?对于有气体参加的反应或制取气体的反应,在装药品之前一定要首先检查装置的气密性。然后才可以进行实验。(3)①Cu与浓H2SO4在加热时发生反应。反应的方程式为:Cu+2H2SO4(浓)  CuSO4+ SO2↑+2H2O?。装置D盛有NaHCO3饱和溶液,因为酸性H2SO3> H2CO3所以二者发生反应产生CO2,反应的方程式为NaHCO3+ SO2= NaHSO3+ CO2,装置E中盛有酸性KMnO4溶液,能把SO2氧化为硫酸,但是与CO2不发生反应。所以装置E中足量酸性KMnO4溶液的作用是除去为完全反应SO2气体。②如果碳元素的非金属性比硅元素非金属性强,则酸性H2CO3> H2SiO3把CO2通入到Na2SiO3的溶液中就会发生反应:CO2+H2O +Na2SiO3= Na2CO3+ H2SiO3↓。看到实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀。③因为元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。但是H2SO3不是S的最高价含氧酸。因此不能依据试管D中的实验现象,证明硫元素的非金属性强于碳元素的非金属性。试管D中若通入的SO2少量,发生反应的离子方程式是SO2+2HCO3-=SO32-+ H2O+CO2↑;或若通入的SO2足量,发生反应的两种方程式是SO2+HCO3-= HSO3- +CO2↑。
CuSO4+ SO2↑+2H2O?。装置D盛有NaHCO3饱和溶液,因为酸性H2SO3> H2CO3所以二者发生反应产生CO2,反应的方程式为NaHCO3+ SO2= NaHSO3+ CO2,装置E中盛有酸性KMnO4溶液,能把SO2氧化为硫酸,但是与CO2不发生反应。所以装置E中足量酸性KMnO4溶液的作用是除去为完全反应SO2气体。②如果碳元素的非金属性比硅元素非金属性强,则酸性H2CO3> H2SiO3把CO2通入到Na2SiO3的溶液中就会发生反应:CO2+H2O +Na2SiO3= Na2CO3+ H2SiO3↓。看到实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀。③因为元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。但是H2SO3不是S的最高价含氧酸。因此不能依据试管D中的实验现象,证明硫元素的非金属性强于碳元素的非金属性。试管D中若通入的SO2少量,发生反应的离子方程式是SO2+2HCO3-=SO32-+ H2O+CO2↑;或若通入的SO2足量,发生反应的两种方程式是SO2+HCO3-= HSO3- +CO2↑。
本题难度:一般
3、选择题 某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可以表示为nZnO*SiO2,则n值等于?
参考答案:C
本题解析:由题意得:
nZnO·SiO2 ~ nZn
81n+60?65n
100%? 58.6%
(81n+60)∶65n=100%∶58.6%
n=2
本题难度:简单
4、选择题 微型音像磁带中的磁性材料的化学组成相当于CoxFe3-xO4+x若x值为0.5,则下列说法正确的是(?)
A.含有Co3+、Fe3+
B.含有Co3+、Fe3+、Fe2+
C.其中Co3+与Fe2+的物质的量之比为1∶1
D.其中Co3+与Fe3+的物质的量之比为1∶4
参考答案:A
本题解析:当x=0.5时,磁性材料的化学组成为Co0.5Fe2.5O4.5,根据选项分析Co为+3价,再根据化合物中正负化合价代数和为0,可确定Fe为+3价。
本题难度:简单
5、计算题 有一铅锡合金质量为100g,完全氧化后得到氧化物的混合物质量为116g,求合金中铅、锡的质量分数各为多少?
参考答案:合金中铅、锡分别占56.8%、43.2%
本题解析:解法一:
分析:设100g铅锡合金中含锡xg,则含铅(100-x)g。①Sn氧化后的稳定产物是SnO2(+4价氧化物稳定),Sn的相对原子质量为

Pb氧化后的稳定产物是PbO(+2价氧化物稳定), Pb的相对原子质量为207,PbO的式量为223,(100-x)g Pb氧化生成的PbO质量必
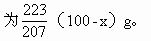
因为SnO2与PbO质量共为116g,故可列一元一次方程,解方程求出Sn、Pb质量。
[解] 设100g锡铅合金中含锡xg,含铅为(100-x)g。
根据化学式所表示的元素质量分数及题意,列代数方程式:
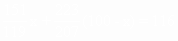
解得x=43.2(g)
100-x=100-43.2=56.8(g)

答:合金中锡、铅质量分数分别为43.2%、56.8%
解法二:
分析:此题利用物质的量计算也很方便。设100g合金中含xg,含铅为(100-x)g
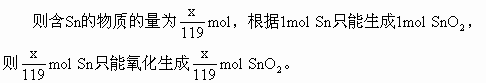

将SnO2与PbO由物质的量换算成质量,质量和为116g。
解:设100g锡铅合金中含锡为xg,含铅为(100-x)g
Sn的物质的量=SnO2的物质的量

Pb的物质的量=PbO的物质的量

SnO2与PbO质量和为116g
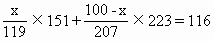
解得 x=43.2(g)
(锡的质量)
100-x=56.8(g)
(铅的质量)
本题难度:简单