1、推断题 (三选一)【选修3:选修物质结构与性质】
已知:A、B、C、E四种短周期元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,?C元素的基态原子L层只有2对成对电子,E元素在第三周期元素中电负性最大。D元素的化合物D3C4具有磁性。
(1)分子式为BC2的空间构型为___________;E元素原子的电子排布式为____________。
(2)?某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有________个σ键,?___________个π键;?其中心原子的杂化类型为____________。
(3)同质量的A2C晶体的密度小于液体(4℃时)的密度,其原因是____________。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子式是__________?,属于___________分子(填:“极性”或“非极性”),该反应的化学方程式是____________________。
(5)①?D与水蒸气反应的化学方程式为_____________;?
②?已知D(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(CO)5晶体属于_____________(填晶体类型)。
2、简答题 如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品.
猜想与假设:(1)用______三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到______金属性逐渐减弱.
(2)因实验室不可能有硅单质,但可以测0.1mol/L的______溶液和______溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出______、______、硫酸三种最高价含氧酸的酸性强弱顺序是______,从而得出从______到______非金属性逐渐增强.
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将______方法,通过______现象便直接得出非金属性S比Cl弱.
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容.
(2)实验结论是______.
(3)请你用物质结构理论知识解释结论.
3、填空题 (1)已知四种短周期元素形成的离子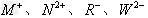 具有相同的电子层结构。?
具有相同的电子层结构。?
①M、N、R、W的原子序数由大到小的顺序是______________。?
②M、N、R、W的原子半径由大到小的顺序是______________。?
③ 的离子半径由大到小的顺序是______________。?
的离子半径由大到小的顺序是______________。?
(2)原子序数大于4的主族元素A和B的离子分别为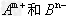 ,已知它们的核外电子排布相同,据此推断
,已知它们的核外电子排布相同,据此推断
①A和B所属周期数之差为(填具体数字)______________。?
②A和B的核电荷数之差为(用含m或n的式子表示)______________。?
③B和A的族序数之差为____________。?
4、简答题 下列是元素周期表的前三周期中的部分元素:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
一
① |
②
二
③
④
⑤
⑥
⑦
三
⑧
⑨
⑩
(11)
|
(1)这些元素中,最活泼的非金属元素是______,最不活泼的元素是______;(写元素名称)
(2)原子结构示意图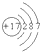 所表示的原子是______.(写元素符号)
所表示的原子是______.(写元素符号)
(3)⑧和⑨两种元素的最高价氧化物对应的水化物都是碱,分别写出这两种碱的化学式:______和______;这两种碱的碱性强弱为:前者______后者(填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式______.
5、选择题 四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列关系能够成立的是
A.原子序数:a>b>c>d
B.a-b=n-m
C.元素非金属性:ZD.最高价氧化物对应水化物的碱性:X>Y