|
高中化学知识点归纳《影响化学反应速率的因素》在线测试(2019年最新版)(四)
2020-07-28 03:53:02
【 大 中 小】
|
1、选择题 下列情况下,反应速率相同的是 ( )
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
|
参考答案:C
本题解析:等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应,盐酸和硫酸的浓度虽然相同,但[H+]不同,化学反应速率不同,A错误;等质量锌粒和锌粉,它们的接触面积不同,化学反应速率不同,B错误;等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应,它们的H+的浓度相同,化学反应速率相同,C正确;等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应,硫酸与石灰石反应,生成物微溶,覆盖在石灰石表面,阻止反应的进行,速率减慢甚至停止,D错误。
考点:考查影响化学反应速率大小的因素。
本题难度:一般
2、选择题 下列列举的各组事实中存在因果关系的是
[? ]
陈述I(原因)
陈述Ⅱ(结果)
A.
O3能吸收紫外线
大气层中的O3被称为地球保护伞
B.
钠原子核外电子数比铝少
钠的金属性比铝强
C.
盐酸的酸性比氢硫酸强
氯元素的非金属性化碳元素强
D.
N2+3H2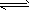 2NH3是放热反应 2NH3是放热反应
工业合成氨的反应在高温下进行
参考答案:A
本题解析:
本题难度:一般
3、填空题 某学生用0.1×10×25㎜3,质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表

(1)写出铝片与酸反应的离子方程式________________________。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是_____________________________。
(3)根据铝片与盐酸和硫酸反应现象的差异,深入思考,可作出如下猜想:
猜想一:____________________________________。
猜想二:____________________________________。
参考答案:(1)2Al+6H+==2Al3++3H2↑
(2)反应放热温度升高,化学反应速率加快
(3)猜想一:Cl-对该反应有促进作用
猜想二:SO42-对该反应有抑制作用
本题解析:
本题难度:一般
4、填空题 (1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI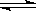 H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=
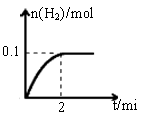
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
参考答案:(1)(每小题3分,共6分)
3CH3COOH+CH2OHCHOHCH2OH  +3H2O +3H2O

2CH3CHOHCH3+O2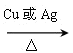 2CH3COCH3+2H2O 2CH3COCH3+2H2O
(2)(4分)(1)0.1mol/(L·min)---2分, (2)a、f--2分
本题解析:(1)甘油中含有3个羟基,所以和乙酸发生酯化反应,消耗3分子乙酸。蔗糖是二糖,水解生成葡萄糖和果糖。2-丙醇中和羟基相连的碳原子上只有1个氢原子,催化氧化的产物是丙酮。
(2)根据图像可知,平衡时氢气的物质的量是0.1mol,所以消耗碘化氢是0.2mol,因此其反应速率是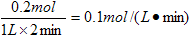 。 。
(3)考查外界条件对反应速率的影响。浓硝酸和浓硫酸都是氧化性酸,和锌反应生成物不是氢气。b和c中可以构成原电池,反应速率可以加快。温度升高,反应速率加快。e是增大反应物的接触面积,反应速率加快。所以答案选af。
本题难度:一般
5、选择题 把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是
A.加入适量FeCl3溶液
B.加入适量KNO3溶液
C.加入适量的K2CO3溶液
D.加入适量Na2SO4溶液
参考答案:D
本题解析:氯化铁水解,溶液显酸性,所以生成的氢气量增加,A不正确;在酸性条件下,硝酸钾具有强氧化性,和金属反应得不到氢气,B不正确;C中的碳酸钾可以消耗氢离子,降低反应速率,但生成的氢气量减少,不正确;硫酸钠溶液相当于是稀释,反应速率降低,且生成的氢气量不变,答案选D。
考点:考查外界条件对反应速率的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是要明确外界条件是如何影响反应速率的,然后结合题意灵活运用即可,有利于培养学生的应试能力和逻辑推理能力。
本题难度:一般
|