1、选择题 下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A.2NO2 N2O4(正反应是放热反应)
N2O4(正反应是放热反应)
B.C(s)+CO2 2CO (正反应是吸热反应)
2CO (正反应是吸热反应)
C.N2+3H2 2NH3(正反应是放热反应)
2NH3(正反应是放热反应)
D.H2S H2+S(s)(正反应是吸热反应)
H2+S(s)(正反应是吸热反应)
参考答案:B
本题解析:略
本题难度:一般
2、选择题 在一定条件下,向一固定容积的容器中投入2molNO2进行反应:2NO2 2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是
2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是
[? ]
A.2?mol?NO、0.75?mol?O2?
B.1?mol?NO2、1.2?mol?NO?
C.2?mol?NO?
D.0.7?mol?O2?
参考答案:D
本题解析:
本题难度:一般
3、填空题 合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。?可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
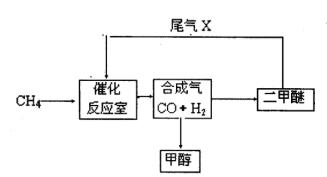
(1)写出用合成气生产二甲醚的化学方程式?。
 ?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
(3)工业上一般采用下列两种反应合成甲醇:
 反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?
反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?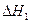
 反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)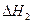
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
由表中数据判断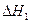 ?0(填“>”、“=”、“<”)。
?0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+ O2(g)
O2(g)?CO2(g)+2H2(g)?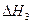 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+ O2(g)
O2(g)?H2O(g)?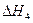 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则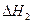 =?。
=?。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式?。
参考答案:(1)①2CO+4H2?CH3OCH3+H2O?3分
(2)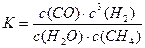 (其它合理表达也给分)? 2分
(其它合理表达也给分)? 2分
(3)① <? 2分?②-48.9kJ·mol-1?3分
(4)CH3OCH3+160H一一12e一?2CO23一+11H2O? 3分
本题解析:略
本题难度:一般
4、选择题 A、B两种物质当浓度恒定时,在不同温度下进行反应:A +3B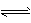 3C。10℃时,反应速率v(B) =0.3 mol.(L.s)-1; 50℃时,反应速率v(A) =25.6 mol.(L.s)-1。若该反应温度每升高10℃,化学反应速率增至n倍,则n值为
3C。10℃时,反应速率v(B) =0.3 mol.(L.s)-1; 50℃时,反应速率v(A) =25.6 mol.(L.s)-1。若该反应温度每升高10℃,化学反应速率增至n倍,则n值为
[? ]
A.4
B.3
C.3.5
D.2.5
参考答案:A
本题解析:
本题难度:一般
5、填空题 (10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1)?反应5min内,v(O2)=_________mol.L-1.min-1.
(2)?化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3)?判断该反应达到平衡的标志是_______________;
A.v消耗(SO2)=v生成(SO3)
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.容器中气体的总物质的量不再变化
参考答案:(1)0.08?(2)80%;0.6 mol.L-1; 0.8 (3)BD
本题解析:(1)考查可逆反应的有关计算。
2SO2?+? O2 2SO3
2SO3
起始量(mol)? 2? 2? 0
转化量(mol)? 1.6? 0.8? 1.6
平衡量(mol)? 0.4? 1.2? 1.6
所以氧气的反应速率是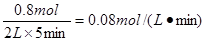
(2)SO2消耗的浓度占起始浓度的百分比为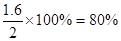
此时氧气的浓度
(3)A中反应速率方向相同,所以不能证明。混合气的密度是混合气的质量和容器容积的比值,质量和容积均不变,所以密度始终是不变的。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但混合气的物质的量是变化的,所以BD正确,即答案是BD。
本题难度:一般