|
高中化学知识点大全《电解池原理》在线测试(2019年最新版)(四)
2020-07-28 03:59:21
【 大 中 小】
|
1、填空题 右图为持续电解含一定CaCl2的溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
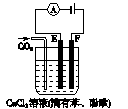 ? ?
(1)电解时,F极发生?反应,电极反应式为?,E极发生?反应,电极反应式为?,电解总反应式为?。
(2)电解池中产生的现象:
①?;
②?;
③?。
参考答案:(1)氧化? 2Cl--2e- Cl2↑?还原? 2H++2e- Cl2↑?还原? 2H++2e- H2↑? 2Cl-+2H2O H2↑? 2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
(2)①通电后E极处溶液呈红色
②通电时,E极、F极均有气体生成
③通CO2时,溶液中先出现白色沉淀,继续通CO2沉淀又消失
本题解析:溶液中含有:Ca2+、H+、Cl-、OH-,通电时,Ca2+、H+移向阴极,由于H+放电能力比Ca2+强,在E极上发生反应:2H++2e- H2↑;Cl-、OH-移向阳极,Cl-在阳极放电;2Cl-+2e- H2↑;Cl-、OH-移向阳极,Cl-在阳极放电;2Cl-+2e- Cl2↑,电解一段时间t1后,溶液中OH-浓度增大,通入CO2后会有CaCO3沉淀生成,继续通入CO2,则白色沉淀溶解。 Cl2↑,电解一段时间t1后,溶液中OH-浓度增大,通入CO2后会有CaCO3沉淀生成,继续通入CO2,则白色沉淀溶解。
本题难度:简单
2、选择题 以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是
A.利用阳极泥可回收Ag、Au等金属
B.阳极减少的质量一定等于阴极增加的质量
C.精炼过程中,CuSO4溶液的浓度不发生改变
D.因部分电能转化为热能,精炼时通过的电量与阴极铜的析出量无确定关系
|
参考答案:A
本题解析:粗铜中含有Al、Zn、Ag、Au等杂质,比铜活泼的铝、锌在电极失电子进入溶液,比铜不活泼的Ag、Au不会失电子,沉积在阳极附近形成阳极泥,A项正确;在精炼铜的过程中,粗铜中铜、铝、锌失电子导致阳极质量减轻,在阴极只有Cu2+得电子生成铜附着在阴极,导致阴极质量增大,所以阳极减少的质量不等于阴极增加的质量,B项错误;精炼过程中,阳极中铜、锌、铝失电子进入溶液,溶液中Cu2+得电子离开溶液,所以精炼过程中,CuSO4溶液的浓度减小,C项错误;阴极发生Cu2++2e-=Cu,所以通过的电量与铜的析出量成正比,D项错误;选A。
考点:考查粗铜的电解精炼。
本题难度:一般
3、选择题 关于下列各装置图的叙述中,错误的是( )
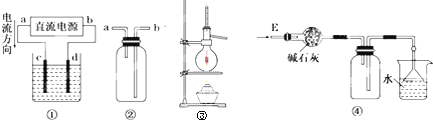
A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③可用于分离沸点相差较大的互溶的液体混合物
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
参考答案:A、电解饱和食盐水时,电流的方向是:外电路从原电池的正极流向负极,所以a是正极,b是负极,即c是在阳极,该极上是氯离子失电子产生能使湿润的淀粉KI试纸变蓝的氯气,故A正确;
B、H2、NH3、Cl2、HCl、NO2可以采用排空气法来收集,收集时H2、NH3,导管是短进长出,Cl2、HCl、NO2的收集是导管长进短出,故B正确;
C、蒸馏或是分馏法可以分离沸点相差较大的互溶的液体混合物,蒸馏烧瓶加热时必须垫上石棉网,故C错误;
D、氨气的收集采用向上排空气法,导管可以短进长出,用碱石灰来干燥,用水来吸收时,要防止倒吸,故D正确.
故选C.
本题解析:
本题难度:简单
4、填空题 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
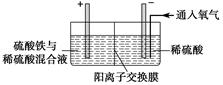
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相) R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
参考答案:(1)①吸收硫化氢气体,防止环境污染
②Fe2+-e-=Fe3+
(2)2H++2e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O
(3)分液漏斗 富集Cu2+、分离Cu2+与其它金属阳离子
(4)增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生
(5)c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
本题解析:(1)根据2Fe3++H2S=2Fe2++S↓+2H+,可判断Fe2(SO4)3的主要作用是氧化H2S气体,防止H2S对环境的污染,当Fe3+被H2S还原为Fe2+后,在阳极上Fe2+-e-=Fe3+,使Fe3+的浓度基本保持不变。
(2)在阴极上,2H++2e-=H2↑,然后Cu2++2e-=Cu,接着在酸性条件下,Cu被O2氧化成CuO,CuO和H2SO4反应生成CuSO4。
(3)有机相和水相不混溶,所以应用分液漏斗分离,由于Cu2+在有机相中,所以加入有机萃取剂可富集Cu2+。
(4)利用化学平衡移动原理解释。
(5)2CuSO4+2H2O 2Cu+2H2SO4+O2↑ 2Cu+2H2SO4+O2↑
0.05 mol? 0.05 mol
所以n(H+)=0.1 mol
由于Cu2+的水解,所以n(Cu2+)<0.05 mol,n(H+)>0.1 mol。
所以c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
本题难度:一般
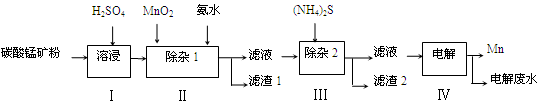
5、简答题 (12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质
| Mn(OH)2
| Co(OH)2
| Ni(OH)2
| MnS
| CoS
| NiS
| Ksp
| 2.1×10-13
| 3.0×10-16
| 5.0×10-16
| 1.0×10-11
| 5.0×10-22
| 1.0×10-22
|
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
参考答案:(12分)
(1)MnCO3+H2SO4 =MnSO4+ CO2↑+H2O (2分,气体符号不扣分)
(2)抑制Mn2+的水解 (2分)
(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(2分)
(4)CoS和NiS (每个1分,共2分)
(5)阴(1分) Mn2++2e-=Mn(1分) (6)1×10-6 mol/L (2分)
本题解析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,所以化学方程式是MnCO3+H2SO4 =MnSO4+ CO2↑+H2O;
(2)根据表中数据可知氢氧化锰是弱碱,所以硫酸锰水解生成氢氧化锰和硫酸,则硫酸过量的第三个作用是抑制锰离子水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,二氧化锰被还原为锰离子,离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据流程图可知,除杂1时,将铁离子除去,则除杂2的目的是除去镍离子和钴离子,根据沉淀的溶度积可知,加入硫化铵后,镍离子和钴离子已硫化物的沉淀除去,所以滤渣2的主要成分是CoS和NiS;
(5)电解时,锰离子在阴极发生还原反应,所以Mn在阴极析出;电极反应式是Mn2++2e-=Mn;
(6)因为KMnS=1.0×10-11,所以欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥KMnS/ c(Mn2+)=1×10-6 mol/L。
考点:考查对工业流程的分析,溶度积的应用,离子方程式的书写
本题难度:困难
|