1、填空题 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的π键数目为_______。
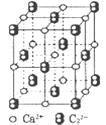
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是______;分子中处于同一直线上的原子数目最多为______。
参考答案:(1)CaC2+2H2O=CH≡CH↑+Ca(OH)2(2)? N>O>C? C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;但O原子最外层电子排布为2s22p4,而N原子最外层电子排布为2s22p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以N元素的第一电离能比O大。(3)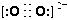 ? 2NA(4)4?(5)1s22s22p63s23p63d10?(6)sp杂化 sp2杂化 3
? 2NA(4)4?(5)1s22s22p63s23p63d10?(6)sp杂化 sp2杂化 3
本题解析:(1)依据教材知识书写,方程式为CaC2+2H2O=CH≡CH↑+Ca(OH)2。
(2) 第二周期元素C、N、O三种元素的第一电离能从大到小顺序为N>O>C ,因为C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;但O原子最外层电子排布为2s22p4,而N原子最外层电子排布为2s22p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以N元素的第一电离能比O大。
(3)根据等电子体原理可知,O22+的电子式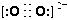 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键。
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键。
(4)由CaC2晶体的晶胞结构可看出在CaC2晶体中1个Ca2+周围距离最近的C22-数目为4个。
(5)Cu是29号元素,其Cu+基态核外电子排布式为1s22s22p63s23p63d10。
(6)在丙烯腈分子中碳原子轨道杂化类型从左到右,第一、第二个C原子的杂化为sp2杂化,第三个C原子的杂化是sp杂化。分子中处于同一直线上的原子数目最多为 3个。
本题难度:一般
2、选择题 在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.CaC2+2H2O→Ca(OH)2+HC≡CH↑
B.2Na2O+2H2O=4NaOH
C.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
D.2NaOH+Cl2=NaCl+NaClO+H2O
参考答案:A
本题解析:
本题难度:简单
3、填空题 溴化碘的化学性质类似于卤素单质,试回答: ?
(1)溴化碘的电子式是____,它是由____(填“极性”或“非极性”)键形成的分子。?
(2)溴化碘可以与镁反应生成溴化镁与碘化镁,该反应中氧化产物是_____________,还原产物是______________。 ?
(3)溴化碘可以与水反应(同Cl2与水的反应相似),写出该反应的化学方程式________________________,其中生成的含氧化合物的电子式为________________。
参考答案:(1)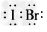 ;极性?
;极性?
(2)MgBr2和MgI2;MgI2?
(3)IBr+ H2O=HIO+HBr;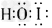
本题解析:
本题难度:一般
4、选择题 下列叙述中正确的是
[? ]
A.在极性分子中不可能存在非极性键
B.在离子晶体中不可能存在极性键
C.在原子晶体中可能存在离子键
D.含有共价键的晶体可能是离子晶体
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列说法正确的是
[? ]
A.由于水中存在氢键,所以水很稳定
B.能与酸反应生成盐和水的氧化物一定是碱性氧化物
C.Na2O2中既含有离子键,又含有非极性键
D.由于C=O键是极性键,所以CO2是极性分子
参考答案:C
本题解析:
本题难度:简单