1、选择题 下面提到的问题中,与盐的水解有关的正确说法是
①明矾和FeCl3可作净水剂.利用铝离子水解形成胶体,利用胶体的强吸附性净水;
②为保存FeCl3溶液,要在溶液中加少量盐酸,抑制三价铁离子水解.
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释,抑制铝离子水解.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂,是因为铵根水解,溶液显酸性.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,碳酸根水解,溶液显碱性缘故.
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂,是利用铝离子和碳酸氢根双水解,产生氢氧化铝和二氧化碳.
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气,是因为铵根水解,溶液显酸性.
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用,铵根和碳酸根双水解,产生氨气,肥效消失.
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性,考虑铵根水解,硫离子水解.
A.①④⑦
B.②⑤⑧
C.③⑥⑨
D.全有关
参考答案:D
本题解析:①明矾和FeCl3可作净水剂.利用铝离子水解形成胶体,利用胶体的强吸附性净水;
②为保存FeCl3溶液,要在溶液中加少量盐酸,抑制三价铁离子水解.
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释,抑制铝离子水解.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂,是因为铵根水解,溶液显酸性.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,碳酸根水解,溶液显碱性缘故.
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂,是利用铝离子和碳酸氢根双水解,产生氢氧化铝和二氧化碳.
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气,是因为铵根水解,溶液显酸性.
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用,铵根和碳酸根双水解,产生氨气,肥效消失.
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性,考虑铵根水解,硫离子水解.
全部涉及到盐类水解。
点评:盐类水解应用。
本题难度:一般
2、选择题 下列有关溶液中微粒浓度关系的叙述正确的是( )。
A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.向CH3COONa溶液中滴加稀盐酸至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH)
D.等物质的量浓度CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-)
参考答案:B
本题解析:阴离子总浓度不可能大于阳离子总浓度,不符电荷守恒,A错误。由NaClO的物料守恒有,c(Na+)=c(HClO)+c(ClO-),由NaHCO3的物料守恒有c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),由于两者等物质的量,则两溶液中c(Na+)相等,B正确。由电荷守恒及溶液呈中性有c(Na+)=c(Cl-)+c(CH3COO-),则c(Na+)>c(Cl-),由CH3COONa的物料守恒有c(Na+)=c(CH3COOH)+c(CH3COO-),得c(Cl-)=c(CH3COOH),C错误。由电荷守恒式有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒式有c(CH3COOH)+c(CH3COO-)=2c(Na+),两式联立得c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),D错误。
本题难度:一般
3、选择题 100mL 0.1 mol·L-1醋酸与50mL 0.2 mol·L-1氢氧化钠溶液混合,在所得溶液中
A.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
B.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
C.C(Na+)>C(CH3COO-)>C(H+)=C(OH-)
D.C(Na+)=C(CH3COO-)>C(OH-)>C(H+)
参考答案:A
本题解析:醋酸的物质的量为0.1L×0.1mol/L=0.01mol,氢氧化钠的物质的量为0.05L×0.2mol/L=0.01mol,则混合后二者恰好完全反应,溶液中的溶质只有CH3COONa,根据电荷守恒可以得到:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为醋酸钠为强碱弱酸盐,所以该溶液显示出碱性,即c(OH-)>c(H+),故c(Na+)>c(CH3COO-),右水解很弱,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A正确。B错误,因为c(OH-)>c(H+);C错误,因为c(OH-)>c(H+);D错误,因为c(Na+)=c(CH3COO-)。
点评:本题考查了盐类的水解,该知识点是高考考查的重点和难点,明确酸碱混合后的溶液中的溶质是解答的关键,然后利用“有弱才水解、谁强显谁性”的水解规律即可解答。
本题难度:一般
4、选择题 下图表示的是某物质所发生的( )
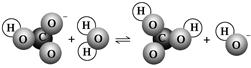
A.取代反应
B.水解反应
C.中和反应
D.电离过程
参考答案:B
本题解析:HCO3—+H2O H2CO3+OH-,属于水解反应。
H2CO3+OH-,属于水解反应。
本题难度:一般
5、填空题 (10分)请仔细观察两种电池的构造示意图,完成下列问题:

锌锰电池的构造?碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
物质
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Mn(OH)2
|
开始沉淀pH
| 2.7
| 7.6
| 5.7
| 8.3
|
完全沉淀pH
| 3.7
| 9.6
| 8.0
| 8.8
|
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
参考答案:(1)Zn+2OH--2e-====Zn(OH)2?
(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大.
(3)①MnOOH、碳粉? ②除去Zn(OH)2和Fe(OH)3?③制备皓矾、回收金属锌等
本题解析:(1)总反应减去正极反应就得负极反应:Zn+2OH--2e-====Zn(OH)2。
(2)从锌锰电池和碱性锌锰电池的结构图可以看出碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大.
(3)①锌锰电池放点后得到MnOOH和Zn(OH)2,因此在废旧电池拆出的锰粉中除了有MnO2、Zn(OH)2外还有MnOOH。
②根据金属离子开始沉淀和完全沉淀的pH,可以看出在pH=8.0时,Zn(OH)2和Fe(OH)3沉淀完全。
滤液4主要含有的是Zn2+,所以可以用来回收金属锌或者制备皓矾。
点评:本题综合性强,主要考查学生分析问题的能力。
本题难度:一般