1、选择题 一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A.加入少量NaOH固体,c(CH3COO-)减小
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:B
本题解析:
正确答案:B
A.不正确,加入少量NaOH固体,水解平衡逆向移动,c(CH3COO-)减大;
B.正确,加入少量FeCl3固体,水解呈酸性,促进CH3COO―水解c(CH3COO-)减小
C.不正确,稀释溶液,促进水解,溶液的pH减小;
D.不正确,加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题难度:一般
2、选择题 为了使(NH4)2SO4溶液中c(NH4+)和c(SO42-)之比更接近2:1,可向溶液中加入少量( )
A.氢氧化钠溶液
B.硫酸
C.盐酸
D.硫酸钠溶液
参考答案:A、加入氢氧化钠溶液会促进铵根的水解,减少铵根离子,c(NH4+)和c(SO42-)之比小于2:1,故A错误;
B、加入硫酸能抑制铵根离子的水解,但加入了硫酸根,不能确定c(NH4+)和c(SO42-)之比更接近2:1,故B错误;
C、加入盐酸,抑制铵根离子的水解,使c(NH4+)和c(SO42-)之比更接近2:1,故C正确;
D、加入硫酸钠溶液,增加了硫酸根,c(NH4+)和c(SO42-)之比更小于2:1,故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 氯化铁水解的离子方程式为 ? ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 ? 。同时有红褐色沉淀生成,其原因是 ? 。
参考答案:Fe3++3H2O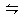 3H++Fe(OH)3;2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
3H++Fe(OH)3;2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
本题解析:氯化铁溶液中Fe3+水解的离子方程式为Fe3++3H2O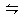 3H++Fe(OH)3;向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,是由于Fe3+水解造成的酸性与碳酸钙反应的结果,即2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
3H++Fe(OH)3;向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,是由于Fe3+水解造成的酸性与碳酸钙反应的结果,即2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
本题难度:一般
4、填空题 常温下某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合溶液的pH如下表:
实验编号
| HA的浓度(mol·L-1)
| NaOH的浓度(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| c
| 0.2
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=9
|
(1)不考虑其他组的实验情况,单从甲组分析如何用a来分析HA属于强酸还是弱酸:_____。
(2)不考虑其他组的实验情况,单从乙组分析c是否一定等于0.2?________。混合溶液中离子浓度c(A-)与c(Na+)的大小关系为________。
(3)从丙组结果分析HA是________酸,该混合溶液中离子浓度大小关系为________。
(4)丁组实验混合溶液中由水电离的c(OH-)=_____________mol·L-1。
参考答案:(1)若a=7,HA为强酸,若a>7,HA为弱酸
(2)否 c(A-)=c(Na+)
(3)弱c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5
本题解析:甲实验中酸和碱恰好完全反应生成NaA盐溶液,若a=7,HA为强酸,若a>7,HA为弱酸。乙实验中如果HA为强酸,c=0.2 mol·L-1,若HA为弱酸,c>0.2 mol·L-1。pH=7说明溶液显中性,c(H+)=c(OH-),由电荷守恒可知,c(A-)=c(Na+)。丙组实验时HA过量的情况下混合液显碱性说明HA为弱酸。混合溶液中c(H+)<c(OH-),溶液中离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)。常温下KW=10-14,所以当混合溶液的pH=9时,由水电离的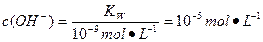 。
。
本题难度:简单
5、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是(?)
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3
参考答案:C
本题解析:NH4+在水溶液中发生水解反应:NH4++H2O 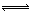 NH3?H2O+H+,水解程度越小,NH4+的浓度就越大,NH4HSO4为强酸的酸式盐,电离产生的H+抑制NH4+的水解,NH4Cl、NH4NO3没有其他离子影响,NH4HCO3为弱酸的酸式盐,显碱性,促进NH4+的水解,故NH4HSO4中NH4+浓度最大,C项正确。
NH3?H2O+H+,水解程度越小,NH4+的浓度就越大,NH4HSO4为强酸的酸式盐,电离产生的H+抑制NH4+的水解,NH4Cl、NH4NO3没有其他离子影响,NH4HCO3为弱酸的酸式盐,显碱性,促进NH4+的水解,故NH4HSO4中NH4+浓度最大,C项正确。
本题难度:一般