1、选择题 下列有关实验操作的说法正确的是( )
A.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
B.用50mL的量筒量取20.00?mL?KMnO4溶液
C.用加热方法提取NH4Cl固体中混有的少量碘
D.用蒸馏方法分离苯和硝基苯的混合物
参考答案:D
本题解析:
本题难度:简单
2、简答题 用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的
Ba(OH)2溶液,每次实验均充分反应.实验记录见下表:
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀质量/g
1
0.858
0.5
1.379
2
1.716
0.5
______
3
2.574
0.5
4.137
4
3.432
0.5
5.516
5
4.290
0.5
5.516
6
5.148
0.5
5.516
|
回答下列问题:
(1)第2次实验中产生沉淀的质量是______;
(2)Ba(OH)2溶液物质的量浓度是______;
(3)通过计算确定样品中NaHCO3和K2CO3的物质的量之比是______.
参考答案:(1)第3次、第4次生成沉淀碳酸钡的质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,第1次、第3次样品的质量分别为0.858g、2.574g,第1次、第3次生成沉淀碳酸钡质量分别为1.379g、4.137g,样品的质量之比等于生成的沉淀质量之比为1:2,说明第3次恰好完全反应,第2次实验中样品完全反应,令产生沉淀质量为mg,则:
1.716g:2.574g=mg:4.137g,解得m=2.758,故答案为:2.758g;
(2)实验中每次滴加相同浓度的Ba(OH)2溶液50.5L,第5次、第5次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,碳酸钡的物质的量为5.516g197g/mol=0.028mol,根据钡离子守恒可知,氢氧化钡的物质的量为0.028mol,所以Ba(OH)2溶液中溶质的物质的量浓度是0.028mol0.5L=0.056mol/L,故答案为:0.056mol/L.
(3)第3次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,则:
本题解析:
本题难度:一般
3、简答题 “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是______,另一同学判断出错的原因是______.
(2)丙的实验①说明维生素C具有较强的______性(填“氧化”或“还原”).
(3)写出与丙的实验②中现象对应的离子反应方程式______;______
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理______
(5)针对实验目的,本次实验尚未完成的任务是______.
参考答案:(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理,
故答案是:乙; 亚铁盐在空气中易被氧气氧化;
(2)由于三价铁离子具有氧化性,加入维生素后淡红色褪去,铁离子被维生素还原成了亚铁离子,
故答案是:还原;
(3)②中现象对应的反应方是氯气和亚铁离子的反应及硫氰化钾与铁离子反应生成血红色的硫氰化铁,反应的离子方程式是:2Fe2++Cl2=2 Fe3++2Cl-,Fe3++3SCN-═Fe(SCN)3,
故答案是:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3;
(4)若是氯水将SCN-氧化了,可以重新加入硫氰化钾溶液,观察现象,如果变成血红色,第二种假设合理;如果不变色,说明第一种假设合理,
故答案是:再加过量KSCN溶液,如果变血红色,则第二种合理;如果不变色,则第一种合理;
(5)根据“某研究性学习小组为探究其主要成分,进行了如下实验”,本次实验尚未完成的任务是:未能测出“速力菲”成分,
故答案为:未能测其成分.
本题解析:
本题难度:一般
4、实验题
|
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)

(1)判断BaCl2已过量的方法是_____________________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2) ;
___________________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是_______。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是_______。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_____________________;步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:____________________________
参考答案:(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
(2)CaCl2+Na2CO3==CaCO3↓+2NaCl,BaCl2+Na2CO3==BaCO3↓+2NaCl
(3)NaOH;过滤
(4)否;过量的BaCl2必须要用Na2CO3除去; 是;
(5)会有部分沉淀溶解,从而影响制得精盐的纯度
本题解析:
本题难度:一般
5、实验题 有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
(1)验证组成元素将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置。(夹持仪器的装置已略去)?
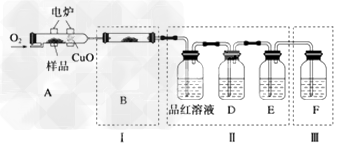
①?写出A中样品燃烧的化学方程式:___________________。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为________。
③D中盛放的试剂是________(填序号)。
a.NaOH溶液b.品红溶液c.酸性KMnO4溶液?d.溴的CCl4溶液e.饱和石灰水
④能证明有机物含碳元素的现象是_________________________。
⑤装置Ⅰ、Ⅱ不能互换的理由是______________________。
⑥燃烧管中放入CuO的作用是____________________。
⑦指出装置F的错误:_____________________。
(2)探究有机物M的分子结构 ?
文献资料表明,该有机物M为二个六元环结构,有很高的对称性,氢原子的环境都相同。将2.04?g该有机物加入溴的CCl4 溶液,充分振荡后溶液褪色,并消耗了0.03?mol?Br2。
⑧该有机物分子结构中含有的官能团为________(填结构式)。
⑨有机物M的结构简式为________(填序号)。
参考答案:(1)①C6H4S4+11O2 6CO2+4SO2+2H2O
6CO2+4SO2+2H2O
②无水硫酸铜
③c?
④E中溶液不褪色或颜色不变浅,F中溶液变浑浊
⑤气体通过Ⅱ时,会带出水蒸气,干扰氢元素的验证?
⑥将有机物中的碳元素全部氧化成二氧化碳?
⑦试剂瓶未与空气相通?
(2)⑧?
⑨h
本题解析:
本题难度:一般