1、选择题 某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中不正确的是( )
A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是使水能顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:从①口进气可收集二氧化碳,从②口进气可收集氢气
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列装置或操作能达到实验目的的是?
[? ]
A.构成铜锌原电池 ?
?
B.检查装置气密性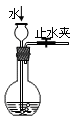 ?
?
C.吸收HCl尾气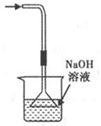 ?
?
D.稀释浓硫酸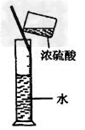
参考答案:B
本题解析:
本题难度:一般
3、选择题 利用下列实验装置能完成相应实验的是?
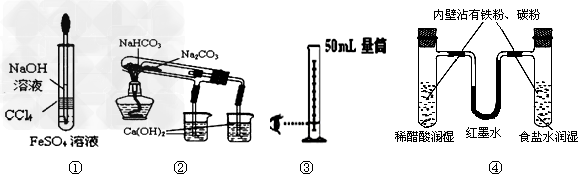
[? ]
A.装置①制备Fe(OH)2?
B.装置②验证NaHCO3和Na2CO3热稳定性
C.装置③量取8.5mL的稀硫酸?
D.装置④模拟铁的腐蚀?
参考答案:D
本题解析:
本题难度:一般
4、实验题 草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:
①称取wg草酸晶体配成100.0mL水溶液;
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·L-1KMnO4溶定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O 请回答下列问题
(1)实验①中为配制准确浓度的草酸溶液,所需用到的仪器是:天平(含砝码)、烧杯、药匙和
___________。
(2)实验②中,滴定时,KMnO4溶液应装在______________(填“酸式滴定管”、“碱式滴定管”或“移液管”中,原因是________________________________。
(3)滴定中,目光应注视__________________,判断滴定结束的标准是____________________。读数时,目光应与凹液面的最______________(填“上”、“下”)端水平。
(4)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为______
_________,由此计算出草酸晶体的X值是___________________。
(5)假设滴定终点时,用去VmL KMnO4溶液,则待测草酸的物质的量浓度为______________mol·L-1。
参考答案:(1)玻璃棒、100mL容量瓶、胶头滴管
(2)酸式滴定管;KMnO4具有强氧化性,会腐蚀碱式滴定管中的橡皮管
(3)锥形瓶中溶液颜色的变化;待测液刚好出现紫色且半分钟内不褪色;上
(4) ;
;
(5) 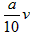
本题解析:
本题难度:一般
5、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤,水洗除去其中的Cl-再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定
Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
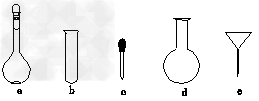
(4)滴定终点的现象是_________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M?g/mol)试样w?g,消耗c?mol/L?NH4Fe(SO4)2标准溶液V?mL,则TiO2质量分数表达式为______________________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
参考答案:(1)TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除尽
(3)抑制NH4Fe(SO4)2水解;a、c
(4)溶液变为红色
(5)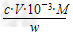 ×100%
×100%
(6)①偏高;②偏低
本题解析:
本题难度:一般