| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》考点特训(2019年冲刺版)(四)
参考答案:D 本题解析: 本题难度:一般 2、填空题 (1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)的质量比______,密度比______;同质量的氨气和硫化氢的体积比为______;若二者有相等的氢原子数,则它们的体积比为______. 参考答案:(1)同温同压下,体积之比等于物质的量之比,同体积的氨气(NH3)和硫化氢(H2S)的物质的量相等,根据m=nM可知二者质量之比为=17g/mol:34g/mol=1:2,同温同压下,密度之比等于摩尔质量之比为17g/mol:34g/mol=1:2; 本题解析: 本题难度:简单 3、选择题 相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度为cmol/L,密度为ρg?cm-3,则下列说法正确的是( )
B.物质的量浓度C可表示为:
C.溶液的质量分数ω%可表示为:
D.溶液密度ρ可表示为:
参考答案:A、mg:m(溶质)=(1-ω%):ω%,所以m(溶质)=mω%1-ω%g,所以VL22.4L/mol×Mg/mol=mω%1-ω%g, 本题解析: 本题难度:一般 4、选择题 在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为( ) |
参考答案:B
本题解析:设Na+、SO42-、OH-物质的量分别为8mol、1mol、2mol,由电荷守恒得Cl-物质的量为4mol。所以硫酸钠、氯化钠、氢氧化钠物质的量分别为1mol、4mol、2mol。
考点:化学计算
点评:本题关键是理解溶液中含有四种离子:Na+、SO42-、Cl-、OH-,根据电荷守恒可快速计算出Cl-物质的量。
本题难度:一般
5、选择题 用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是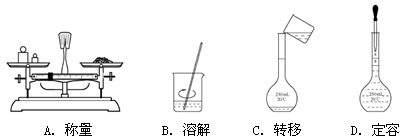
参考答案:B
本题解析:A、天平称量时左物有码,而图中是左码右物了,错误;B、溶解时用玻璃棒不断搅拌,目的是加速溶解,正确;C、配制溶液中转移液体需要玻璃棒引流,图中缺少玻璃棒,错误;D、定容时,胶头滴管不能伸入容量瓶,应是容量瓶口正上方,错误。
考点:考查实验的基本操作。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《氯及其化合.. | |