|
高中化学知识点讲解《与量有关的离子方程式的书写》高频试题巩固(2019年最新版)(六)
2020-07-28 04:54:15
【 大 中 小】
|
1、选择题 能正确表示下列反应的离子方程式为
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.Fe3+溶液中滴加过量的氨水: Fe3++3OH-=Fe(OH)3↓
C.Cu2+溶液中滴加过量的氨水: Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积均匀混合:
| 6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+?
参考答案:D
本题解析:漂白粉溶液在空气中失效的生成物是碳酸钙和次氯酸,次氯酸不稳定,分解生成氧气和氯化氢,A不正确。氨水是弱碱在离子方程式中不能改写成离子的形式,B不正确。当氨水过量时,氢氧化铜会溶解在氨水中形成络合物CuNH34(OH)2。C不正确。答案是D。
本题难度:一般
2、选择题 下列反应的离子方程式书写正确的是?(?)
A.含1molFeCl2的溶液中通入1molCl2 Fe2++Cl2=Fe3++2Cl-
B.NaClO溶液中通入过量的SO2气体 ClO-+SO2+H2O
C.在足量热的稀硫酸中不断通入空气氧化废铜 2Cu+O2+4H+=2Cu2++2H2O
D.工业上将硫酸工业尾气SO2持续通入氨水中 SO2+OH-=HSO3一
参考答案:C
本题解析:A 错误,未配平
B 错误,次氯酸有强的氧化性,会把亚硫酸根离子氧化为硫酸根离子
C 正确。
D 错误,氨水应写成分子形式,不能写OH-离子形式
本题难度:一般
3、选择题 下列反应的离子方程式的书写中,正确的是( )
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O? ?2OH-+Cl2↑+H2↑
B.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
C.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
D.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
参考答案:A.用惰性电极电解MgCl2溶液的离子反应为Mg2++2Cl-+2H2O??电解?.??Mg(OH)2↓+Cl2↑+H2↑,故.A错误;
B.向氢氧化钠溶液中通入少量二氧化硫的离子反应为SO2+2OH-=SO32-,故B错误;
C.碳酸氢钠溶液与足量氢氧化钡溶液混合的离子反应为HCO3-+Ba2++OH-=BaCO3↓+H2O,故C正确;
D.将磁性氧化铁溶于盐酸的离子反应为Fe3O4+8H+═2Fe3++Fe2++4H2O,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 化学用语是学习化学的重要工具.以下化学用语表示错误的是( )
A.质量数之和是质子数之和两倍的水分子符号可能是:
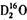
B.NaHCO3水溶液呈碱性的原因:

C.硫离子的电子排布式:
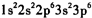
D.熔融状态下硫酸氢钠的电离方程式:
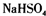
(熔融)═
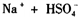
参考答案:A、
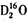
中质子数为10,原子质量数之和为16+4=20,质量数之和是质子数之和的2倍,故A正确;
B、NaHCO3水溶液呈碱性的原因是碳酸氢根的水解程度大于电离程度,题目中是碳酸氢根的电离,故B错误;
C、硫离子核外有18个电子,核外电子排布式为1s222s2p63s23p6,故C正确;
D、硫酸氢钠是由钠离子与硫酸氢根离子构成的离子化合物,熔融下电离出钠离子与硫酸氢根离子,故D正确.
故选B.
本题解析:
本题难度:简单
5、选择题 下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
编号
| 化学反应
| 离子方程式
| 评价
| A
| 碳酸钙与醋酸反应
| CO32-+2CH3COOH
=2CH3COO-+H2O+CO2↑
| 错误,碳酸钙是弱电解质,不拆写
| B
| Ba(HCO3)2溶液中通入过量NaOH溶液
| Ba2++HCO3-+OH-=BaCO3↓+H2O
| 正确
| C
| 碳酸氢钠的水解
| HCO3-+H2O OH-+H2CO3 OH-+H2CO3
| 正确
| D
| 等物质的量的FeBr2和Cl2反应
| 2Fe2++2Cl2=2Fe3++4Cl-
| 正确
|
?
参考答案:C
本题解析:A、碳酸钙与醋酸反应的离子反应为CaCO3+2CH3COOH=CO2↑+H2O+Ca2++2CH3COO-,碳酸钙不溶于水,但属于强电解质,故A错误;B、Ba(HCO3)2溶液中通入过量NaOH溶液生成物是碳酸钡、碳酸钠和水,反应的离子方程式为Ba2++2HCO3-+2OH-=BaCO3↓+2H2O+CO32-,评价错误,故B错误;C、NaHCO3的水解的离子反应为HCO3-+H2O H2CO3+OH-,评价正确,故C正确;D、由于亚铁离子的还原性强于溴离子的还原性,所以等物质的量的FeBr2和Cl2反应,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,评价错误,故D不正确,答案选C。 H2CO3+OH-,评价正确,故C正确;D、由于亚铁离子的还原性强于溴离子的还原性,所以等物质的量的FeBr2和Cl2反应,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,评价错误,故D不正确,答案选C。
本题难度:一般
|