1、实验题 用酸碱中和滴定法测定某烧碱的纯度。
(1)配制待测溶液将已称好的2.100g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250ml溶液,所需的主要仪器有_______________。
(2)滴定
①盛装0.1890mol/L盐酸标准液应该用_______式滴定管,滴定管装液前,先用蒸馏水洗涤,再用要盛放的溶液__________。
②准确量取待测液25.00 mL于洁净锥形瓶中,再向锥形瓶中加入1-2滴指示剂,进行滴定操作,达到滴定终点时有关数据记录如下。
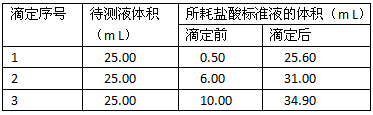
(3)计算 NaOH溶液的物质的量浓度为 _________,烧碱样品的纯度为_________。
(4)下列几种操作对c(NaOH)的影响(填“偏高” 、“偏低”或“无影响” )
①若用蒸馏水冲洗锥形瓶,则会使c(NaOH)_______;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使c(NaOH)_______;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使c(NaOH)_______;
④读数时,若开始时仰视读数,滴定结束时俯视读数,则会使c(NaOH)_______;
参考答案:(1)250mL容量瓶, 烧杯, 玻璃棒, 胶头滴管
(2) ①酸 ;润洗
(3)0.189mol/L ;90%
(4)①无影响; ②偏高; ③偏低; ④偏低
本题解析:
本题难度:一般
2、选择题 用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( )
A.用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B.用蒸馏水洗涤锥形瓶后再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C.用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定
D.若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列实验操作中,所使用的有关仪器要求干燥的是( )
A.中和滴定所用的锥形瓶
B.做喷泉实验时,用来收集氯化氢气体的圆底烧瓶
C.配制一定物质的量浓度溶液时所用的容量瓶
D.实验室制取氨气时用于收集氨气的集气瓶
参考答案:BD
本题解析:
本题难度:一般
4、选择题 下列实验操作会引起实验结果偏高的是
A.测定硫酸铜晶体中结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B.镀锌铁皮锌镀层厚度测量实验中,将铁皮小火烘干、称量时,最后两次称量前后质量不相等
C.一定浓度的盐酸配制过程中,用量筒量取计算所需的浓盐酸时,仰视观察刻度线
D.滴定实验时,装待测液的滴定管用蒸馏水洗净后,没有用待测液润洗2~3次
参考答案:C
本题解析:分析:A.根据加热后放在空气中冷却,会吸收空气中的水重新形成晶体,前后质量差减小,结果偏小;
B.根据测量原理厚度d=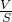 =
=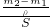 来分析;
来分析;
C.根据c=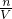 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
D.根据c(待测)=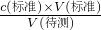 分析;
分析;
解答:A.在硫酸铜晶体(CuSO4?n?H2O)结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,加热后放在空气中冷却,会吸收空气中的水重新形成晶体,反应前后质量差减小,结果偏小,故A错误;
B.镀锌铁皮锌镀层厚度测量实验中,将铁皮小火烘干、称量时,最后两次称量前后质量不相等,说明铁粉已被氧化,导致质量差偏小,根据测量原理厚度d=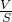 =
=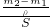 可知,测定结果偏低,故B错误;
可知,测定结果偏低,故B错误;
C.一定浓度的盐酸配制过程中,用量筒量取计算所需的浓盐酸时,仰视观察刻度线,会导致量取液体的体积偏大,所配溶液浓度偏的,故C正确;
D.滴定实验时,装待测液的滴定管用蒸馏水洗净后,没有用待测液润洗2~3,待测液的浓度偏小,导致一定体积待测液的物质的量偏小,最终V(标)偏小,根据c(待测)=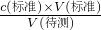 分析,可知C(待测)偏小,故D错误;
分析,可知C(待测)偏小,故D错误;
故选:C;
点评:本题主要考查了测定结果的误差分析,掌握实验的原理及正确的误差分析是解题的关键,题目难度不大.
本题难度:简单
5、简答题 某学生用中和滴定法测定某烧碱的纯度.实验如下:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制成1000mL的溶液,除烧杯、胶头滴管、玻璃棒、量筒外,还需要的玻璃仪器有______.
(2)用标准?0.1mol/L的盐酸溶液滴定NaOH溶液的实验操作如下:
A.用碱式滴定管取稀NaOH溶液?20mL,注入锥形瓶中,加入指示剂.
B.用待测定的NaOH溶液润洗碱式滴定管.
C.用蒸馏水洗干净滴定管.
D.酸式滴定管用标准的HCl溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E.检查滴定管是否漏水.
F.另取锥形瓶,再重复操作两次.
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
①滴定操作的正确顺序是(用序号填写):______.
②该滴定操作中应选用的指示剂是:______.
③在G操作中,如何确定终点:______.
(3)酸式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴定结果(填“偏小”、“偏大”或“无影响”)______;酸式滴定管读数时,若先俯后仰,则结果会______.
(4)有关数据记录如下,计算烧碱样品的纯度(保留到小数点后二位):______
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL
滴定前
滴定后
1
20.00
0.50
20.72
2
20.00
1.20
21.38
3
20.00
2.00
22.20
参考答案:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到1000ml容量瓶?容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是天平、药匙、烧杯、量筒、玻璃棒、1000ml容量瓶、胶头滴管,故答案为:1000ml容量瓶;?
(2)①中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作,故答案为:B→A→G→F;?
②NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,
故答案为:酚酞或甲基橙;?
③用酚酞作指示剂时,当滴进最后一滴溶液由红色变无色,且半分钟内不变色,则到达滴定终点;根据用甲基橙作指示剂时,溶液由黄色变橙色,且半分钟内不变色,则到达滴定终点.
故答案为:用酚酞作指示剂时,当滴进最后一滴溶液由红色变无色,且半分钟内不变色,则到达滴定终点;根据用甲基橙作指示剂时,溶液由黄色变橙色,且半分钟内不变色,则到达滴定终点.
(3)酸式滴定管用蒸馏水润洗后,未用标准液润洗,标准液浓度降低,造成V(标)偏大,根据c(待测)=V(标)×c(标)V(待测)分析可知c(待测)偏大;酸式滴定管读数时,若先俯后仰,读数差增大,造成V(标)偏大,根据c(待测)=V(标)×c(标)V(待测)分析可知c(待测)偏大;故答案为:偏大;偏大;?
(4)所耗盐酸标准液的体积分别为:20.22mL,20.18mL,20.20mL,三组数据均有效,盐酸标准液的平均体积为20.20mL;
? HCl~NaOH
? ?0.1mol/L×20.20mL?C(NaOH)×20mL
C(NaOH)=0.101mol/L,则1000mL的溶液中含有NaOH的质量为:0.101mol/L×1L×40g/mol=4.04g,算烧碱样品的纯度为4.04g5.00g×100%=80.80%,故答案为:80.80%;
本题解析:
本题难度:一般
|