Na2CO3溶液
参考答案:C
本题解析:加入BaCl2溶液会与Na2CO3反应生成BaCO3沉淀和NaCl,混入了新杂质,A错。金属Cu与FeCl3反应生成FeCl2和CuCl2混入铜离子,B错;3NO2+H2O==2HNO3+NO,可以除去NO2,且不混入新杂质,C对;Na2CO3溶液与CO2反应生成NaHCO3,D错。
本题难度:一般
2、选择题 下列混合物中,不能用分液漏斗分离的是
A.乙醇和水
B.硝基苯和水
C.溴苯和水
D.四氯化碳和水
参考答案:A
本题解析:略
本题难度:简单
3、选择题 已知丙酮通常是无色的液体,不溶于水,密 度小于1 g?cm-3,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,应选用(?) 度小于1 g?cm-3,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,应选用(?)
A.过滤
B.蒸馏
C.分液
D.蒸发
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (12分)海水综合利用的工艺流程图如下:
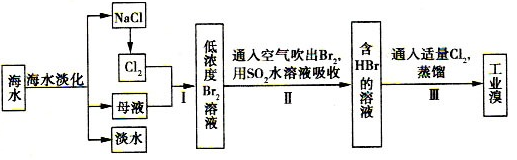
(l)步骤II用SO2水溶液吸收Br2,吸收率可达95%。
①有关反应的离子方程式为?;
②该过程中除环境保护外,在工业生产中应解决的主要问题是?;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是?;实验室中采用??方法可以起到同样的作用。
(3)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在氯化氢氛围下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①写出直接加热MgCl2·6H2O的化学方程式?;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由:?。
参考答案:
(1)Br2+SO2+2H2O=4H++SO42-+2Br-?强酸对设备的严重腐蚀?
(2)富集溴元素?萃取分液
(3)①MgCl2·6H2O? ?MgO+2HCl↑+5H2O ?MgO+2HCl↑+5H2O
②不同意,因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本。
本题解析:(1)反应产生强酸,具有腐蚀作用;(2)步骤I中已获得Br2是低浓度的,需要进一步富集达到工业生产的目的;实验室中采用有机溶剂萃取分液的方法达到富集溴;(3)将MgCl2·6H2O在加热时会发生水解生成氢氧化镁,氢氧化镁受热分解得到氧化镁,故应在HCl气氛中加热,抑制MgCl2水解;因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本,所以采用电解MgCl2。
本题难度:一般
5、实验题 下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
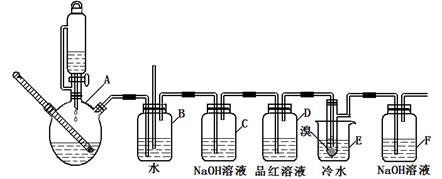
有关数据列表如下:
?
| 乙醇
| 1,2-二溴乙烷
| 乙醚
| 状态
| 无色液体
| 无色液体
| 无色液体
| 密度/g/cm3
| 0.79
| 2.2
| 0.71
| 沸点/℃
| 78.5
| 132
| 34.6
| 熔点/℃
| 一l30
| 9
| -1l6
|
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:____________________________________________________________。
(2)气体发生装置使用连通滴液漏斗的原因_________________________________________。
(3)装置D中品红溶液的作用是_______________;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象_______________________________________。
(4)反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是_____________________________________________。
(5)判断该制备反应已经结束的方法是__________________;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是_______________________________________。
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是____________________________。
参考答案:(1)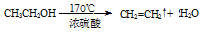 (2分) (2分)
(2)使连通滴液漏斗里的溶液容易滴下(2分)
(3)验证二氧化硫是否被除尽;玻璃管中液面上升(2分);
(4)减少液溴挥发;1,2—二溴乙烷易凝结成固体而发生堵塞(2分)
(5)E中液体由红棕色变为无色;副反应发生或反应太剧烈(2分);
(6)是;乙烯和液溴均易溶于四氯化碳(2分)
本题解析:(1)在加热和催化剂的作用下乙醇发生消去反应生成乙烯,然后乙烯和溴水发生加成反应生成1,2-二溴乙烷,反应的化学方程式是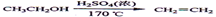 。 。
(2)气体发生装置使用连通滴液漏斗,主要是兴液面上下的大气压强相同,使连通滴液漏斗里的溶液容易滴下。
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;;同时B装置是安全瓶,若E中发生堵塞,玻璃管中液面肯定会上升。
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;;但又不能过度冷却(如用冰水),其原因是1,2—二溴乙烷易凝结成固体而发生堵塞。
(5)判断该制备反应已经结束的方法是E中液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是副反应发生如生成乙醚或反应太剧烈使部分乙醇挥发。
(6)乙烯和液溴均易溶于四氯化碳,可进行充分吸收,故可行。
本题难度:一般
|