|
高中化学知识点大全《物质的量》高频考点巩固(2019年模拟版)(四)
2020-07-28 05:04:19
【 大 中 小】
|
1、实验题 欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的仪器有:
①量筒 ②烧杯 ③玻璃棒④____________,⑤____________。
(2)下列各操作正确的顺序为____________________________。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗涤所用仪器2至3次,洗涤液也转入容量瓶中
| E.稀释浓H2SO4?
F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②浓硫酸稀释后在转入容量瓶前应____________,否则会使浓度偏____________。
③定容时必须使溶液液面与刻度线相切,若俯视会使浓度偏___________。
参考答案:(8分)(1)500mL容量瓶 胶头滴管 (每空1分)
(2)A、E、F、D、C、B (2分)
(3)①13.6 (1分)
②恢复至室温(1分) 高(1分)
③高(1分)
本题解析:考查一定物质的量浓度溶液的配制以及有关误差分析等。
(1)配制500ml稀硫酸,则需要500ml容量瓶,定容时还需要胶头滴管。
(2)根据配制原理及实验要求可知,正确的操作顺序是A、E、F、D、C、B。
(1)①由于在稀释过程中溶质是不变的,所以需要浓硫酸的体积是
 。 。
②由于浓硫酸溶于水放出大量的热,所以在转移至容量瓶之前需要恢复至室温。如果不冷却即转移,则根据热胀冷缩可知,容量瓶中溶液的体积偏少,因此浓度偏高。
③根据c=n/V可知,若定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏高。
本题难度:一般
2、选择题 硫酸越浓密度越大.现有98%的硫酸溶液的物质量浓度为C1,49%的硫酸溶液的物质量浓度为C2,则C1和C2的关系( )
A.C1=2C2
B.C1>2C2
C.C1<2C2
D.无法确定
参考答案:设98%的硫酸溶液的密度为ρ1g/ml,49%的硫酸溶液的为ρ2g/ml.
98%的硫酸溶液的物质量浓度为C1=1000×ρ1×98%98mol/L=10ρ1mol/L.
49%的硫酸溶液的物质量浓度为C2=1000×ρ2×49%98mol/L=5ρ2mol/L.
由于硫酸越浓密度越大,所以ρ1>ρ2.
所以C1>2C2.
故选:B.
本题解析:
本题难度:简单
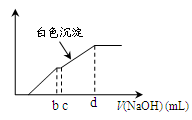
3、选择题 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为
A.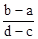
B.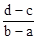
C.
D.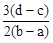
参考答案:D
本题解析:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0-amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,令氢氧化钠浓度为xmol/L,Fe3+完全沉淀消耗氢氧化钠为(b-a)mL,结合Fe3++3OH-═Fe(OH)3↓可知,溶液中n(Fe3+)=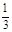 ×(b-a)×10-3Lxmol/L, ×(b-a)×10-3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d-c)mL,结合Mg2++2OH-═Mg(OH)2↓可知,溶液中n(Mg2+)= ×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)= ×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)= ×(d-c)×10-3Lxmol/L: ×(d-c)×10-3Lxmol/L: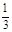 ×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。 ×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
本题难度:一般
4、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,三种溶液中Cl-的物质的量浓度之比为( )
A.1:1:1
B.1:2:3
C.3:4:3
D.3:2:1
参考答案:设NaCl、MgCl2、AlCl3三种溶液的物质的量浓度为C,则氯化钠溶液中氯离子的物质的量浓度等于C,氯化镁溶液中氯离子的物质的量浓度等于2C,氯化铝溶液中氯离子的物质的量浓度等于3C,同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中氯离子的物质的量浓度之比为1:2:3,与溶液与溶液的体积无关;
故选:B.
本题解析:
本题难度:简单
5、简答题 Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题:
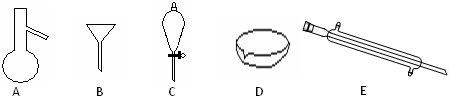
(1)写出仪器A、C、E的名称______
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:______?汽油和水:______
Ⅱ.实验室用固体烧碱配制200mL?0.5mol?L-1的NaOH溶液.
(1)需称量______?g?烧碱,应放在______中称量、溶解.
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有______
(3)请描述定容操作应采取的具体方法______.
参考答案:Ⅰ(1)图中A是蒸馏烧瓶、C是分液漏斗、E是冷凝管,故答案为:蒸馏烧瓶、分液漏斗、冷凝管;
(2)食用油和酒精,互溶,沸点相差较大,可以采取分馏的方法分离,需要用到的仪器为蒸馏烧瓶、冷凝管等,汽油和水为互不相溶的液体,可以利用分液方法分离,需要的仪器为分液漏斗,
故答案为:AE;C;
Ⅱ(1)没有200mL容量瓶,应选择250mL容量瓶,故需要氢氧化钠的质量为0.25L×0.5mol?L-1×40g/mol=5.0g,
氢氧化钠具有腐蚀性、易潮解,应放在烧杯内,迅速称量、溶解,
故答案为:5.0;烧杯;
(2)配制氢氧化钠溶液需要玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管等,
故答案为:250mL容量瓶、胶头滴管;
(3)定容操作为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切,
故答案为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切.
本题解析:
本题难度:一般
|