1、选择题 元素“氦、铷、铯”等是用下列哪种科学方法发现的:
A.红外光谱
B.质谱
C.原子光谱
D.核磁共振谱
参考答案:C
本题解析:测定元素用原子光谱;红外光谱测定有机官能团;质谱测定相对分子量,X射线衍射实验测定晶体结构。答案选C。
点评:本题很基础简单。
本题难度:简单
2、选择题 1862年一位英国化学家根据O2和Xe的第一电离能非常接近,利用类比思想合成第一种稀有气体化合物,大大推动了对稀有气体的研究,为开拓稀有气体化学作出了历史性的贡献。该化学家为(?)
A.巴尔末
B.巴特列
C.洪特
D.范德华
参考答案:B
本题解析:利用类比思想合成第一种稀有气体化合物的英国化学家是巴特列,所以A项正确;其他化学家在电子排布、分子间作用力等方面做出了贡献。
本题难度:简单
3、填空题 (15分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
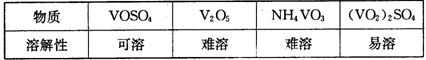
该工艺的主要流程如下:
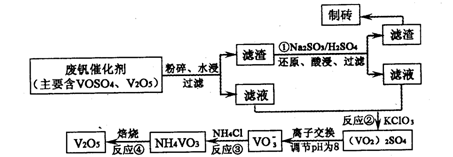
请回答下列问题。
⑴工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为?。
⑵反应①的目的是?。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式:?。
⑷用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。
X为?(写化学式)。

⑸经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如上图所示。则NH4VO3在分解过程中?(填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
参考答案:⑴3V2O5+10Al6V+5Al2O3?⑵将V2O5转化为可溶性的VOSO4
⑶NH+VO===NH4VO3↓?⑷H2O(3分)?⑸B
本题解析:(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式表示为:
3V2O5+10Al6V+5Al2O3;
(2)由流程图可知反应①的目的是:将V2O5转化为可溶性的VOSO4;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,反应的离子方程式为:
NH+VO===NH4VO3↓;
(4)由质量守恒定律可知X为:H2O;
(5)由图分析可得:NH4VO3在分解过程中先分解失去NH3,再分解失去H2O;
本题难度:一般
4、选择题 下列叙述正确的是(?)
A.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素”
B.对于可逆反应N2(g)+3H2(g) 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
C.硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中
D.阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献
参考答案:D
本题解析:A、溴元素被称为“海洋元素”,错误;B、增大氮气浓度可增加单位体积内活化分子的数目,而不是活化分子的百分数,错误;C、不能直接排放到空气中,错误;D、阴极射线是1897年汤姆生做的一个实验,他发现了电子,因此他提出,,原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。于是他提出了糖果布丁模型;卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型,正确。
本题难度:一般
5、填空题 (14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
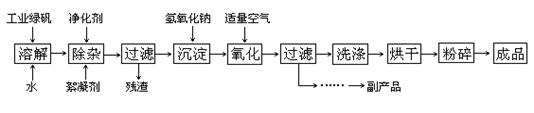
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②? Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O?
③? 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有?;
(2)Fe3O4与稀硝酸反应的离子方程式是?,检验反应后的溶液中含Fe3+的方法?;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:?;
(4)生产中可获得的副产品是?,提取该副产品的操作顺序是?(填写序号)
a.过滤? b.加热浓缩? c.冷却? d.结晶? e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为?L/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:(1)FeO、Fe2O3、Fe3O4?(3分)
(2)3Fe3O4 + 28H++NO3-=9Fe3++NO↑+14H2O? (2分)?取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+ (2分)
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3 (2分)
(4)Na2SO4·10H2O(或芒硝,写Na2SO4也可) (1分)?bcdae? (2分)
(5)784 (2分)
本题解析:(1)铁的主要化合价是+2价和+3价,所以常见氧化物是FeO、Fe2O3、Fe3O4。
(2)硝酸具有强氧化性,Fe3O4中含有亚铁离子,所以二者发生氧化还原反应,生成硝酸铁和NO及水。检验铁离子一般用KSCN溶液,现象是溶液显血红色。
(3)氢氧化亚铁具有还原性,极易被氧化生成氢氧化铁。
(4)根据转化示意图和原子守恒可判断,副产物是硫酸钠。要使溶液中的硫酸钠析出,需要加热浓缩,然后利用溶解度随温度的变化通过冷却结晶,即得到硫酸钠晶体,过滤洗涤即可。
(5)要使产品较纯,则氧气和氢氧化亚铁要恰好反应。根据题意可知,每小时通过的硫酸亚铁是42mol。根据Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O可知,氢氧化亚铁和氢氧化铁的物质的量之比是1︰2的,所以需要氧化氢氧化亚铁是28mol,则消耗氧气是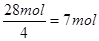 。所以通过的空气是7mol×5×22.4L/mol=784L。
。所以通过的空气是7mol×5×22.4L/mol=784L。
本题难度:一般