| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》练习题(九)
2、填空题 (12分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA
(1)K只与温度有关,当温度升高时,K值________(填“变大”、“变小”或“不变”)。 (2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性相对强弱的关系是_____________________________________________________________。 (3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是________,酸性最弱的是________。 (4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,总有: ,产生此现象的原因是________________________________________________________________________。 3、选择题 下列溶液中有关物质的浓度关系正确的是 |

4、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。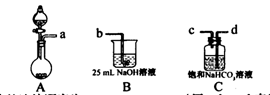
①各装置正确的连接顺序为?(用a、b、c、d表示)。
②检查整套装置气密性的方法是?。
③装置A中常用药品为?;装置C中化学药品的作用是?。
(2)写出步骤三中发生反应的离子方程式?。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法?。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下: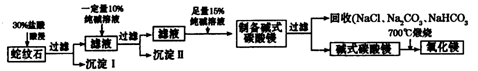
(1)过滤需要的玻璃仪器有?。
(2)沉淀Ⅱ的成分为?,请用离子方程式表示生成沉淀的过程?(写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为?。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____?,
5、选择题 下列说法不正确的是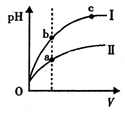
A.等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a 的代数式表示NH3·H2O的电离常数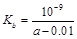
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如上图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《分子式、结.. | |