1、选择题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
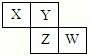
A.原子半径:W>Z>Y>X
B.相等物质的量浓度的气态氢化物溶液的pH: X>Z>W
C.最高价氧化物对应水化物的酸性:Z>W>X
D.四种元素的单质中,Z单质的熔沸点最低
参考答案:B
本题解析:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素。A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;B、四种元素对应的氢化物分别为NH3、H2O、H2S、HCl,其中NH3的水溶液呈碱性,H2O呈中性,H2S为弱酸,HCl的水溶液为强酸,所以相等物质的量浓度的气态氢化物溶液的pH:X>Y>Z>W,故B正确;C、同周期元素从左到右元素的非金属性逐渐增强,根据元素的非金属性越强,对应最高价氧化物的水化物的酸性越强可知最高价氧化物对应水化物的酸性:W>Z,故D错误;D、四种元素对应的单质中,S在常温下为固体,熔沸点最高,其它元素对应的单质在常温下为气体,故D错误。
本题难度:一般
2、选择题 短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物所含化学键的类型完全相同
C.元素B和C的最高价氧化物对应水化物的碱性:B<C
D.元素B、C、D的最高价氧化物对应的水化物能相互反应
参考答案:D
本题解析:A原子的最外层电子数是内层电子数的2倍,说明A原子有2层电子,最外层有4个,所以A为C元素;元素B在同周期的主族元素中原子半径最大,所以B为Na元素;元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族,则C、D是Al、S元素。A、原子半径的比较依据电子层数越多,半径越大,核电荷数越少半径越大,所以B>C>D>A,错误;B、元素A、B的氧化物分别是水和氧化钠,水中含共价键,氧化钠中含离子键,类型不同,错误;C、B的金属性大于C的金属性,所以元素B和C的最高价氧化物对应水化物的碱性B>C,错误;D、元素B、C、D的最高价氧化物对应的水化物分别是氢氧化钠、氢氧化铝、硫酸,三者两两反应,正确,答案选D。
本题难度:一般
3、选择题 下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是
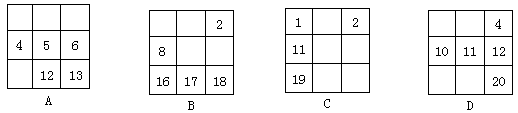
参考答案:B
本题解析:5号元素是B,位于第二周期第ⅢA族,而12号元素Mg位于第三周期第ⅡA族。13号元素Al位于第三周期第ⅢA族.错误。B.元素的结构与位置相符合。正确。C.11号元素Na位于第三周期第ⅠA族;同理19号元素位于第四周期第ⅠA族;错误。D.4号、12号、20号元素都位于第ⅡA族,分别是第二、第三、第四周期的元素;而10号元素Ne位于第二周期0族,第11号元素位于第三周期第ⅠA族。错误。
本题难度:一般
4、选择题 在周期表中,元素性质呈现周期性变化的本质原因是
A.中子数逐渐增大
B.相对原子质量逐渐增大
C.核外电子排布呈现周期性变化
D.元素化合价呈现周期性变化
参考答案:C
本题解析:略
本题难度:简单
5、选择题 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的化合物溶于水能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A~E的顺序依次增大
参考答案:D
本题解析:略
本题难度:简单