1、选择题 在面盆、痰盂等铁制品表面烧制搪瓷的目的是( )
A.防止铁生锈且美观
B.增大厚度防止磨损
C.增大硬度防止撞坏
D.美观和杀菌消毒作用
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列说法正确的是( )
A.防止金属发生电化学腐蚀的牺牲阳极保护法运用了原电池原理
B.电解精炼铜时形成的阳极泥,可以用来提取金、银、铂、铁等金属
C.电镀池的阳极材料只能选用镀层金属
D.原电池中电极反应的反应物一定来源于电极材料或电解质溶液
参考答案:A.防止金属发生电化学腐蚀的牺牲阳极保护法中两种活泼性不同的金属和电解质溶液构成了原电池,所以是运用了原电池原理,故A正确;
B.电解精炼铜时,阳极泥中可以回收不如铜活泼的金属,铁以离子形式存在于溶液中而不能回收,故B错误;
C.电镀时,镀层金属作阳极,故C正确;
D.燃料电池中电极反应的反应物不是来源于电极材料或电解质溶液,故D错误;
故选AC.
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀;③电镀时,应把镀件置于电解池的阴极;④为防止水闸铁门被腐蚀,可让其与直流电源的负极相连;⑤放电时溶液中的阴离子向负极移动;⑥甲烷燃料电池,若其电解质溶液是强碱溶液,则其负极反应式:CH4+8OH--8e-=CO2↑+6H2O
A ①②③④⑤? B.①③④⑤? C.①③⑤⑥? D.③④⑥
参考答案:B
本题解析:加入少量硫酸铜溶液形成原电池能加快反应速率,白铁(镀锌铁)Zn先腐蚀,马口铁(镀锡铁)锡先腐蚀,马口铁(镀锡铁)更易腐蚀②错误A错误。若其电解质溶液是强碱溶液,应该生成碳酸盐,⑥错误CD错误。
本题难度:一般
4、填空题 按图4-7装置进行实验,并回答下列有关问题。
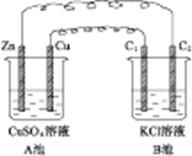
图4-7
(1)判断装置的名称:A池为?,B池为?。
(2)锌为?极,电极反应式为?。铜为?极,电极反应式为?。石墨棒C1为?极,电极反应式为?。石墨棒C2为?极,电极反应式为?。
(3)当C2极上析出224 mL气体(标准状况)时,锌的质量变化了(“增加”或“减少”)?g,CuSO4溶液的质量变化了(“增加”或“减少”)?g。
参考答案:(1)原电池电解池
(2)负Zn-2e-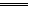 Zn2+
Zn2+
正Cu2++2e-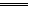 Cu
Cu
阳4OH--4e-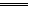 2H2O+O2↑
2H2O+O2↑
阴4H++4e-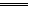 2H2↑
2H2↑
(3)减少0.65?增加0.01
本题解析:A池中Zn、Cu放入CuSO4溶液中,它们构成原电池。B池中,两个电极均为石墨电极,在以A池为电源的情况下构成电解池。即以A为原电池来带动B电解池。A池中Zn为负极,Cu为正极;B池中C1为阳极,C2为阴极,C2极上析出的气体为H2,C2极上析出H2为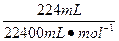 =0.01 mol。
=0.01 mol。
电路上转移电子物质的量为0.01 mol×2=0.02 mol。
因得失电子守恒,故Zn极上有0.01 mol的Zn溶解,即Zn极质量减少0.01 mol×65 g·mol-1=0.65 g。
Cu极上有0.01 mol的Cu析出,即CuSO4溶液的质量增加了0.01 mol×(65-64) g·mol-1=0.01 g。
本题难度:简单
5、选择题 下图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为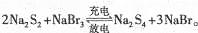 闭合开关K时,b极附近先变红色。下列说法正确的是
闭合开关K时,b极附近先变红色。下列说法正确的是
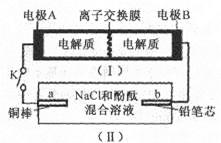
A.当有0.01 mol Na+通过离子交换膜时,b电极上析出112 mL的气体
B.负极反应为3Br--2e-= Br3-
C.闭合K后,b电极附近的pH变小
D.闭合K后.a电极上有氯气产生
参考答案:B
本题解析:A. 在闭合回路中电子转移相同。若有0.01 mol Na+通过离子交换膜时,则外电路转移电子的物质的量也是0.01mol。因为闭合开关K时,b极附近先变红色,说明在b电极为阴极,该电极的电极式为:2H++2e-=H2↑。b电极产生氢气不清楚什么条件,因此无法根据体积确定其物质的量的多少。错误。B是b是阴极,那么B为电源的负极,A为电源的正极。放电时,负极发生的反应为:3Br--2e-= Br3-。正极发生反应:S42-+2e-="2" S22-正确。C.b电极附近溶液变为红色,是因为H+放电使的附近的水的电离平衡被破坏,最终导致附近的c(OH-)增大,pH增大所以变为红色。错误。D. A为电源的正极,则a是电解池的阳极。因为该电极材料Cu是活性电极,电极本身发生氧化反应Cu-2e-=Cu2+。Cl-不失去电子,所以不会产生氯气。.
本题难度:一般