| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《金属的腐蚀与防护》高频试题特训(2019年最新版)(四)
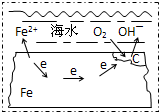 参考答案:钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极. 本题解析: 本题难度:简单 4、选择题 铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是 参考答案:B 本题解析: 本题难度:简单 5、选择题 下列关于金属的腐蚀说法正确的是( ) 参考答案:A、电化学中,原电池的负极和电解池的阳极金属腐蚀速率远远快于金属发生化学腐蚀的速率,故A错误; 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《葡萄糖和果.. | |