1、选择题 下列关于Al2O3的说法正确的是
[? ]
A.Al2O3也可以通过分解反应制得
B.Al2O3是两性氧化物
C.Al2O3非常致密,所以可用铝制容器盛盐酸和NaOH溶液等
D.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝纷纷滴落下来
参考答案:AB
本题解析:
本题难度:简单
2、选择题 进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
[? ]
A.SO2气体通入溴水(橙红色)褪色,表现了SO2的漂白性;足量的二氧化硫通入紫色石蕊试液中先变红后褪色,因为生成酸使其变红,又因为SO2的漂白性,使其褪色
B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应
D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜
参考答案:B
本题解析:
本题难度:简单
3、填空题 (12分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
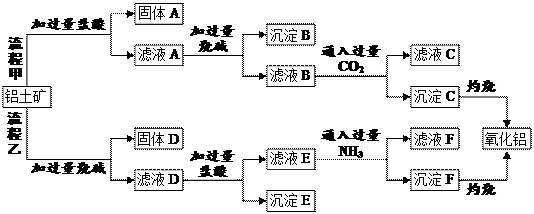
请回答下列问题:
⑴流程甲中,固体A的主要成分是______(填化学式,下同),沉淀B的主要成分是_______,生成沉淀C的离子方程式为__________________。
⑵流程乙中,加过量烧碱时发生反应的离子方程式为________________,沉淀E的主要成分是_________。
⑶生成沉淀F的离子方程式为____________________________________。
参考答案:(12分,化学式各1分,离子方程式各2分)
⑴(1分)SiO2,(2分)Fe(OH)3、Mg(OH)2,
(2分) 或
或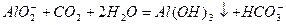
⑵(各2分) 、
、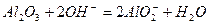 或
或 ,(1分)H2SiO3或H4SiO4
,(1分)H2SiO3或H4SiO4
⑶(2分)
本题解析:略
本题难度:简单
4、填空题 I、某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
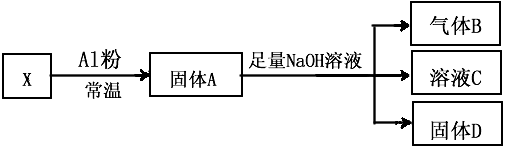
(1)生成气体B的化学方程式是____________________________。
(2)将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液。 写出当加入双氧水时溶液中发生反应的离子方程式:________________________ 。
(3)若已知固体X的质量为7.2g反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是____________ g.
II、混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(4)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应:____________________________;
②混合物A中NaHCO3的质量为____________________g。
(5)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的
Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
参考答案:(1)2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(2)2Fe2++H2O2+2H+==2Fe2++2H2O?
(3)5.28
(4)①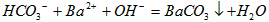 ;②16.8g
;②16.8g
(5)5.3g
本题解析:
本题难度:一般
5、填空题 (13分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
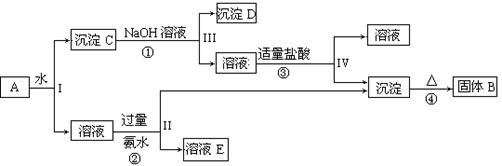
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是?。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B?;沉淀D?。
(3)写出①、②反应的离子方程式:
①?;②?;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
?
参考答案:(1)过滤;(2)Al2O3;;Fe2O3;
(3)①Al2O3+2OH- =2AlO2-+H2O?(2分)?
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+(2分)
(4)Fe2O3?+ 6HCl =" 2" FeCl3?+ 3 H2O?;(2分) ?(其余合理答案也可给分)
2FeCl3?+ Fe = 3FeCl2?(2分)
本题解析:根据题意知,混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤可得KAl(SO4)2溶液和Al2O3、Fe2O3沉淀混合物C,向混合物C中加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3, NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液KAl(SO4)2中通入过量氨气生成氢氧化铝沉淀和溶液E,溶液E为K2SO4和(NH4)2SO4混合物;(1)根据题给流程图知,I、II、III、IV四步为溶液和沉淀的分离,采取的方法是过滤;(2)由以上分析可知B为Al2O3,D为Fe2O3;(3)反应①为Al2O3和氢氧化钠的反应,方程式为Al2O3+2NaOH=2NaAlO2+H2O,反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3、H2O=Al(OH)3↓+3 NH4+;(4)以Fe2O3为原料,可制备FeCl2溶液,可将氧化铁先与盐酸反应,生成氯化铁和水,然后再加入过量铁粉充分反应后过滤即得氯化亚铁溶液,反应方程式为Fe2O3?+ 6HCl =" 2" FeCl3?+ 3 H2O?;2FeCl3?+ Fe = 3FeCl2。
本题难度:一般