1、选择题 实验室制备氨气,检验是否收集满的正确方法是
A.用手扇动收集的气体,有气味则已收集满
B.将润湿的淀粉?KI试纸接近瓶口,试纸变蓝则已收集满
C.将润湿的红色石蕊试纸伸入瓶内,试纸变蓝则已收集满
D.将润湿的红色石蕊试纸接近瓶口,试纸变蓝则已收集满
参考答案:D
本题解析:将润湿的红色石蕊试纸接近瓶口,试纸变蓝则已收集满
本题难度:一般
2、实验题 (18分)某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A ??B ?
(2)实验室提纯粗盐的实验操作依次为:
取样、??、沉淀、过滤、??、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器除玻璃棒、托盘天平、药匙、烧杯外还需要的有___________________、______________________,
③观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同)。没有进行操作④,会________;?
参考答案:(1)Ca(OH)2或CaO;? Na2CO3?(2)溶解;蒸发
(3)①2.9g?①②③④⑤
②500ml容量瓶、胶头滴管③偏高偏低 (每空2分)
本题解析:(1)沉淀剂A来源于石灰窑厂,则A是氢氧化钙或氧化钙。粗盐中含有钙、镁离子等杂质,所以还需要碳酸钠除去钙离子,即B是碳酸钠。
(2)过滤之前需要先溶解,要得到氯化钠晶体,需要蒸发。
(3)①500 mL 0.1mol/L的NaCl中含有0.05mol氯化钠,质量是0.05mol×58.5g/mol=2.925g,所以应该用托盘天平称量2.9g。
②准确配制一定物质的量浓度溶液时需要相应规格的容量瓶,即500ml容量瓶;定容时需要胶头滴管。
③根据c=n/V可知,俯视刻度线,则容量瓶中溶液的体积偏小,浓度偏高;如果没有洗涤,则溶质偏少,浓度偏低。
本题难度:一般
3、选择题 下列气体中。不能用直接排空气法收集的是
[? ]
A.NO2
B.NO
C.CO2
D.N2
参考答案:B
本题解析:
本题难度:简单
4、填空题 (14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
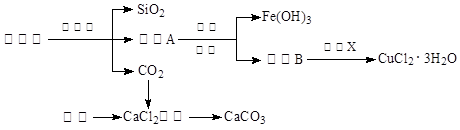
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质
| pH (开始沉淀)
| pH(完全沉淀)
|
Fe(OH)3
| 1.9
| 3.2
|
Fe(OH)2
| 7.0
| 9.0
|
Cu(OH)2
| 4.7
| 6.7
|
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至??(填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是?。
⑵操作X包括??、??、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是??。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是??。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将??(选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为??。
参考答案:⑴3.2-4.7?取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
⑵蒸发浓缩?冷却结晶? CuO
⑶①酸式滴定管
②偏小
③50.0%
本题解析:(1)因为要沉淀氢氧化铁,而不能沉淀氢氧化铜,所以根据物质沉淀的pH数据可知pH不能超过4.7,但要大于3.2。若沉淀不完全,则溶液中一定含有铁离子,所以可利用KSCN来检验。
(2)要从溶液中析出氯化铜晶体,需要经过蒸发浓缩、冷却结晶。氯化铜在溶液中存在电离平衡,而加热促进水解,所以最终得到的是氢氧化铜,灼烧得到氧化铜。
(3)要量取25.00mL盐酸需要算式滴定管,若碱式滴定管未用NaOH溶液润洗,则相当于稀释了氢氧化钠,则消耗的氢氧化钠溶液体积偏大,因此最终测CaCO3的质量分数将偏小。消耗氢氧化钠的物质的量是0.015L×0.1mol·L-1=0.0015mol,需要的盐酸是0.0015mol,因此与碳酸钙反应的盐酸是0.0025mol-0.0015mol=0.001mol,所以碳酸钙的物质的量是0.0005mol,质量是0.05g,所以胃药中碳酸钙的质量分数为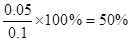 。
。
本题难度:一般
5、选择题 实验室里可按如图所示的装置干燥气体R,多余的气体可用水吸收,则R是( )
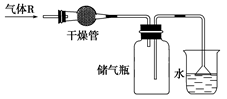
A.NO2
B.NH3
C.CO2
D.HCl
参考答案:B
本题解析: A、碱石灰能与NO2发生反应,故A错误;
B、氨气易溶于水,碱石灰可以干燥氨气,故B正确;
C、二氧化碳能与碱石灰反应,故C错误;
D、碱石灰能与HCl反应,故D错误;
故选B。
点评:解答本题时既要考虑物质的水溶性,又要考虑气体是否能和干燥剂发生化学反应,完成此题,可以依据物质的性质进行。
本题难度:一般