1、选择题 下列关于四个量子数的说法中,正确的是(?)。
A.电子的自旋磁量子数是±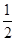 ,表示一个原子轨道中的2个电子的运动状态完全相反
,表示一个原子轨道中的2个电子的运动状态完全相反
B.磁量子数m=0的轨道都是球形的轨道
C.角量子数l的可能取值是从0到n的正整数
D.多电子原子中,电子的能量决定于主量子数n和角量子数l
参考答案:D
本题解析:自旋磁量子数为±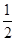 ,只表示一个原子轨道中的两个电子的自旋方向相
,只表示一个原子轨道中的两个电子的自旋方向相
反,既然在同一原子轨道中,它们的主量子数、角量子数和磁量子数都相同,
故A错误;角量子数为零时,对应的为s轨道,在空间呈球形伸展方向,
故B错误;l最大值为(n-1),故C项错误。
本题难度:一般
2、填空题 (15分)1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成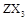 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的?极反应物。
(2)化合物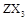 所含化学键种类为?
所含化学键种类为? ?,属于?化合物(填
?,属于?化合物(填 “离子”或“共价”)。
“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为?。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下 列问题:
列问题:
(1)?黄铁矿( )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
 ,有3mol
,有3mol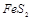 参加反应,转移?mol电子。
参加反应,转移?mol电子。
氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?;从腐蚀废液回收得到金属铜,还需要的试剂是?。
(2)?与明矾相似,硫酸铁也可用作净水剂,其原理是 ?。
?。
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
参考答案:(15分)I(1)负(1分)?(2)共价键(1分),共价(1分)
(3) (2分)
(2分)
Ⅱ、(1)32(2分)(2) (2分)铁粉、稀盐酸(稀硫酸)(2分)
(2分)铁粉、稀盐酸(稀硫酸)(2分)
(3) 水解:
水解: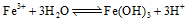 生成有吸附作用的
生成有吸附作用的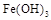 胶体,吸附水中悬附物一起沉淀从而净水(2分)
胶体,吸附水中悬附物一起沉淀从而净水(2分)
(4)
 (2分)
(2分)
本题解析:略
本题难度:一般
3、选择题 下列元素中价电子排布不正确的是( )
A.V:3d34s2
B.Cr:3d44s2
C.Ar:3s23p6
D.Ni:3d84s2
参考答案:B
本题解析:随着原子核外电子层数的增多,核外电子排布出现能级交错现象,如3d能量高于4s,所以按照构造原理排布时,就要先排满4s,再排3d。此外还要注意:当轨道全充满(s2、p6、d10)、半充满(s1、p3、d5)或全空(p0、d0)时更稳定,所以B中元素Cr的价电子排布应为3d54s1。错因:对轨道全充满、半充满等是原子的稳定状态理解不准。与Cr相似的还有Cu,其价电子排布为3d104s1,而不是3d94s2。
本题难度:一般
4、选择题 下列有关性质的比较中,正确的是?(?)
A.热稳定性:H2S>HCl>HBr>HI
B.熔点:Na2O >MgO>CaO
C.微粒半径:F-<Na+<Mg2+
D.还原性:H2S>HCl >HF
参考答案:D
本题解析:略
本题难度:简单
5、推断题 A、B、C、D、E、F六种短周期元素,原子序数依次增大。A是地壳中含量最高的元素,C是地壳中含量最高的金属元素,A、E同主族。D元素原子最外层电子数是次外层电子数的一半。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。
回答下列问题:
(1)元素A在元素周期表中的位置是?。
(2) 写出B、E两元素形成化合物的电子式:?,所含化学键类型?;
(3)A、D、E、F的气态氢化物的稳定性顺序?(用化学式表示)
(4)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
??
(5)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:
?、??
参考答案:(1)第二周期,ⅥA族?;?
(2) 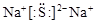 ?离子键?
?离子键?
(3) H2O> HCl>H2S>SiH4
(4)2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O?
(5)Al2O3 +2OH— ==2AlO2— +H2O? SiO2 + 2OH— ==SiO32— +H2O
本题解析:A是地壳中含量最高的元素,故A为O,C是地壳中含量最高的金属元素,故C为Al,A、E同主族,故E为S;D元素原子最外层电子数是次外层电子数的一半,故D为Si;B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,故B为Na,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数,故F为Cl,所以A、B、C、D、E、F分别为O、Na、Al、Si、S、Cl。(1)元素A在元素周期表中的位置是:第二周期,ⅥA族;(2) B、E两元素形成化合物为硫化钠,其电子式为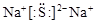 ,所含化学键类型为离子键;(3)根据元素的电负性越大,气态氢化物越稳定,所以A、D、E、F的气态氢化物的稳定性顺序为:H2O> HCl>H2S>SiH4;(4)C、E对应的最高价氧化物的水化物分别为氢氧化铝和硫酸,两者发生的化学反应方程式为:2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O;
,所含化学键类型为离子键;(3)根据元素的电负性越大,气态氢化物越稳定,所以A、D、E、F的气态氢化物的稳定性顺序为:H2O> HCl>H2S>SiH4;(4)C、E对应的最高价氧化物的水化物分别为氢氧化铝和硫酸,两者发生的化学反应方程式为:2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O;
(5)C、D的氧化物分别为氧化铝和二氧化硅,其与氢氧化钠的反应的离子方程式分别为:
Al2O3 +2OH— ==2AlO2— +H2O? SiO2 + 2OH— ==SiO32— +H2O。
点评:本题考查了元素周期表、元素周期律、元素及其化合物,解答本题的关键是先推断出A、B、C、D、E、F分别为O、Na、Al、Si、S、Cl,然后再解答,本题难度中等。
本题难度:一般