1、选择题 下列有关表达正确的是(? )
A.硫离子的电子排布式:1s22s22p63s23p4
B.N原子最外层电子的轨道表示式:
C.CO2分子的结构式: O="C=O"
D.2-甲基-1-丙醇的结构简式:
参考答案:C
本题解析:略
本题难度:简单
2、填空题 某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。
请回答下列问题:
(1)符合上述条件的元素共有______种。
(2)在符合上述条件的元素中,原子序数最小的在周期表的________区(用符号填空),原子序数最大的在周期表的第_____周期、____族。
(3) 过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+?颜色(填“无”或“有”)。
(4)符合上述条件的元素中,原子序数最大、且与水分子形成的配合物有颜色的简单离子的符号为?。
参考答案:(1)3(2分)? (2)s(2分)? 4(2分) ?ⅠB(2分)(3)有(2分)?(4)Cu2+(2分)
本题解析:(1)该电子的电子层数n=4,说明是第四周期元素。元素原子的最外电子层只有一个电子,所以符合条件的元素有K、Cr、Cu。
(2)在符合上述条件的元素中,原子序数最小的元素是K,在周期表的s区;原子序数最大的是铜,在周期表的第四周期、第IB族。
(3)Mn的4d轨道含有5个电子,所以[Mn(H2O)6]2+有颜色。
(4)符合上述条件的元素中,原子序数最大是铜,与水分子形成的配合物有颜色的简单离子的符号为Cu2+。
点评:该题是基础性试题的考查,主要是考查学生对元素周期表结构以及核外电子排布的熟悉了解程度,意在培养学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力,提高学生的应试能力。
本题难度:一般
3、填空题 (10分)下表为周期表的一部分,其中的编号代表对应的元素。
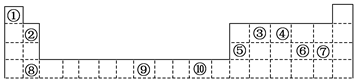
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为?对。
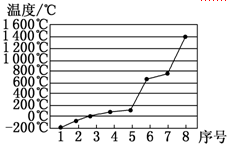
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填元素符号)。
参考答案:(1)⑨? (2)1S22S22P63S23P63d64S2?(3)? 1? (4)? Si? Cl
本题解析:属于d区的元素是⑨,⑨是Fe基态原子的电子排布式为1S22S22P63S23P63d64S2。根据电子排布式nsnnpn+1可知n=2,所以最外层电子的成对电子有1对,“8”代表的元素沸点最高,第三周期中沸点最高的是Si,电负性最大的是Cl。
点评:本题非常基础简单,主要考查学生对元素周期律的掌握。
本题难度:一般
4、选择题 下列各组微粒半径(R)之比大于1的是?
A.R(Mg)/R(Na)
B.R(P)/R(Cl)
C.R(Al3+)/R(Na+)
D.R(K)/R(Br)
参考答案:B、D
本题解析:同周期元素(主族),从左到右随着核电荷递增,原子半径、阳离子半径或阴离子半径都依次减小。钠和镁都位于元素周期表第3周期,钠在镁的左边,钠原子半径大于镁原子,R(Mg)/R(Na)小于1,A错。磷和氯都位于第3周期,磷在氯左边,磷的原子半径大于氯,R(P)/R(Cl)大于1,B对。钠和铝都失去外层电子成为阳离子,都具有两个电子层,铝的核电荷数大于钠。铝对核外电子吸引力大,铝离子的半径小于钠离子,它们的半径比值小于1,C错。钾和溴都位于第4周期,都是主族元素,钾的原子半径大于溴,两原子半径比大于1,D对。
本题难度:一般
5、填空题 (6分)在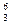 Li、
Li、 N、
N、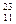 Na、
Na、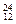 Mg、
Mg、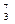 Li、
Li、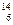 C中:
C中:
(1)?和?互为同位素。
(2)?和? 质量数相等,但不能互称同位素。
质量数相等,但不能互称同位素。
(3)?和?的中子数相等,但质子数不相等,所以不是同一种元素。
参考答案:(每空1分)
(1)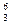 Li 、
Li 、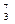 Li?(2)
Li?(2) N、
N、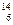 C?(3)
C?(3)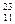 Na、
Na、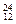 Mg
Mg
本题解析:略
本题难度:简单