1、选择题 设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24L己烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
参考答案:D
本题解析:A.1mol甲醇中含有C—H键的数目为3NA,A错误;B.25℃,pH=13的NaOH溶液中含有OH-的数目,缺少体积,无法计算;B错误;C.标准状况下,己烷是液体,C错误;D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA,D正确,选D。
本题难度:一般
2、选择题 配制一定体积、一定物质的量浓度的溶液,下列操作会使配得的溶液浓度偏小的是( )
A.容量瓶中原有少量蒸馏水
B.定容时观察液面俯视
C.滴管加水时,有少量水滴到容量瓶外
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
参考答案:D
本题解析:
本题难度:一般
3、填空题 (12分)(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数________(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数________(填“大于”、“小于”或“等于”)40%。
(2)已知98%的浓H2SO4的物质的量浓度为18.4 mol·L-1,试判断49%的H2SO4的物质的量浓度________(填“大于”、“小于”或“等于”)9.2 mol·L-1。
(3)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________ 。
(4)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是__________ L,质量是________ g。
参考答案:(1)等于 大于 (2)小于(3)XY3 (4)11.2 14
本题解析:
试题解析:(1)设原硫酸质量为m,30%的H2SO4溶质为质量0.4m,50%的H2SO4溶质的质量为0.5m;混合后体积发生变化但质量不变,所以w(H2SO4)=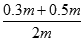 ×100%=40%;如果等体积混合,设体积分别为Vml,30%的H2SO4溶液密度为ρ1,50%的H2SO4溶液密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=
×100%=40%;如果等体积混合,设体积分别为Vml,30%的H2SO4溶液密度为ρ1,50%的H2SO4溶液密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=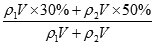 ×100%,因硫酸的浓度越大,密度越大,则ρ1<ρ2,则w(H2SO4)>40%;(2))根据c=
×100%,因硫酸的浓度越大,密度越大,则ρ1<ρ2,则w(H2SO4)>40%;(2))根据c=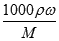 计算,设98%的浓H2SO4的密度为x,49%的H2SO4溶液的密度为y,物质的量浓度为c,则:
计算,设98%的浓H2SO4的密度为x,49%的H2SO4溶液的密度为y,物质的量浓度为c,则: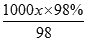 =18.4,
=18.4,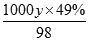 =c,所以:
=c,所以: =
=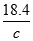 ,因硫酸的浓度越大,密度越大,则x>y,则:c<9.2mol/L。(3)根据阿伏加德罗定律可知,1molX2和3molY2化合生成2mol的气体化合物,所以根据原子守恒即质量守恒定律可知,该化合物的化学式是XY3。(4)设CO的物质的量为Xmol,CO2的物质的量为Ymol,则28X+44Y=36,X+Y=1,解得X=Y=0.5,则CO的体积=0.5mol×22.4L/mol=11.2L ,质量为=0.5mol×28g/mol=14g。
,因硫酸的浓度越大,密度越大,则x>y,则:c<9.2mol/L。(3)根据阿伏加德罗定律可知,1molX2和3molY2化合生成2mol的气体化合物,所以根据原子守恒即质量守恒定律可知,该化合物的化学式是XY3。(4)设CO的物质的量为Xmol,CO2的物质的量为Ymol,则28X+44Y=36,X+Y=1,解得X=Y=0.5,则CO的体积=0.5mol×22.4L/mol=11.2L ,质量为=0.5mol×28g/mol=14g。
考点:溶液浓度的计算
本题难度:一般
4、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是(? )
A.28g乙烯和丙烯所含的碳原子数为为6NA
B.1L0.1mol?L-1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
参考答案:C
本题解析:A中乙烯和丙烯的最简式都是CH2,则28g乙烯和丙烯所含的碳原子数为为2NA,A不正确;乙酸是弱电解质,存在电离平衡,所以B中1L0.1mol·L-1乙酸溶液中H+数小于0.1NA,B不正确;甲烷分子中含有10个质子,C正确;标准状况下,乙醇不是气态,不能适用于气体摩尔体积,D不正确,答案选C。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
5、选择题 用氢氧化钠固体配制0.1mol/L的氢氧化钠溶液,下列说法错误的是( )
A.定容时俯视,会造成浓度偏高
B.转移时不慎将转移液溅出,会造成浓度偏低
C.称量时托盘上要垫上干净的称量纸
D.定容摇匀后发现液面下降,不应继续加水
参考答案:A、定容时俯视,导致所配溶液的体积偏小,根据c=nV分析可知所配溶液的浓度偏高,故A正确;
B、转移时不慎将转移液溅出,导致溶质的物质的量偏小,根据c=nV分析可知所配溶液的浓度偏低,故B正确;
C、氢氧化钠易潮解,应放到玻璃器皿中称量,故C错误;
D、定容摇匀后发现液面下降,过会儿滞留在刻度线以上的液体会下落,最终与刻度线相切,所以不应继续加水,故D正确;
故选:C;
本题解析:
本题难度:一般