|
|
|
高考化学试题《化学反应与能量》试题特训(2019年最新版)(十)
2020-08-13 04:24:53
【 大 中 小】
|
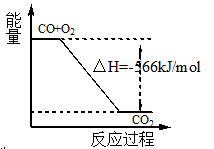
1、选择题 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" -566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" -226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为566 kJ/mol
B.图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物质的量为为2 mol
|
参考答案:CD
本题解析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;一氧化碳的燃烧热为283KJ/mol;故A错误;B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;分析图象中一氧化碳和氧气物质的量为1、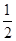 物质的量不符合反应物质的物质的量;故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol;所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;D、已知:Na2O2(s)+CO2(g)=Na2CO3(s)+ 物质的量不符合反应物质的物质的量;故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol;所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;D、已知:Na2O2(s)+CO2(g)=Na2CO3(s)+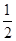 O2(g)△H=-226kJ/mol,若CO2(g)与Na2O2(s)反应放出452kJ热量,则参加反应的过氧化钠是2mol,所以电子转移的物质的量为为2 mol,故D正确,答案选CD。 O2(g)△H=-226kJ/mol,若CO2(g)与Na2O2(s)反应放出452kJ热量,则参加反应的过氧化钠是2mol,所以电子转移的物质的量为为2 mol,故D正确,答案选CD。
点评:本题考查了,热化学方程式的书写方法和计算应用是解题关键,题目难度中
考点:考查热化学方程式的计算应用,燃烧热概念计算分析
本题难度:一般
2、填空题 依据事实,写出下列反应的热化学方程式
① 2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量
______________________________________________________________
② 1克甲烷完全燃烧生成二氧化碳和液态水放出了aKJ的热,写出甲烷燃烧热的热化学方程式:
_____________________________________________________________
③ 12g镁在氧气中完全燃烧,生成氧化镁固体,放出247KJ的热量
参考答案:①H2(g) + I2(g) = 2HI(g) ΔH= -14.9kJ/mol ②CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH=
-16a kJ/mol ③Mg(s) + 1/2O2(g) ="=" MgO(s) ΔH=" -494" kJ/mol
本题解析:
试题解析:①由题意知,1molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出14.9KJ的热量,故热化学方程式为:H2(g) + I2(g) = 2HI(g) ΔH= -14.9kJ/mol;②1g甲烷燃烧生成CO2和液态水时放热akJ,1mol甲烷的质量为16g,故16g甲烷燃烧生成CO2和液态水时放热16akJ,热化学方程式为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH="-16a" kJ/mol;③12g镁的物质的量为0.5mol,故1mol镁在氧气中完全燃烧,生成氧化镁固体,放热为494KJ,热化学方程式为:Mg(s)+1/2O2(g)="=MgO(s)" ΔH="-494" kJ/mol。
考点: 热化学方程式书写
本题难度:一般
3、选择题 在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
A.①
B.①②
C.②
D.全部正确
参考答案:C
本题解析:固体的反应速率与其表面积大小有关,表面积越大,反应越快。此题中,反应速率大小顺序为:粉末>薄片>颗粒。实验序号A、B、C的温度每升高5 ℃,固体溶解时间变为原来的 ,可知D实验的溶解时间应该也是原来的 ,可知D实验的溶解时间应该也是原来的![]() ,即为50 s。只有C选项是对的。 ,即为50 s。只有C选项是对的。
本题难度:一般
4、选择题 下列说法正确的是( )
A.当?H
|
参考答案:
本题解析:
本题难度:一般
5、选择题 下列变化中,必须加入还原剂才能实现的是
A.MnO2→Mn2+
B.Zn→Zn2+
C.H2→H2O
D.CuO→CuCl2
参考答案:A
本题解析:分析:必须加入还原剂才能实现氧化还原反应,说明该物质作氧化剂,得电子化合价降低,据此分析解答.
解答:A、MnO2→Mn2+中锰元素得电子化合价降低,所以二氧化锰作氧化剂,必须加入还原剂才能实现,故A正确.
B、Zn→Zn2+中锌失电子化合价升高,所以锌作还原剂,必须加入氧化剂才能实现,故B错误.
C、H2→H2O中氢元素失电子化合价升高,所以氢气作还原剂,必须加入氧化剂才能实现,故C错误.
D、CuO→CuCl2中铜元素化合价不变,所以不是氧化还原反应,故D错误.
故选A.
点评:本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,难度不大.
本题难度:简单