1、简答题 下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
参考答案:A、加水不能改变浓度水的浓度,对反应速率没有影响,故A错误;
B、浓硫酸具有强氧化性,与铁发生钝化反应,没有氢气生成,不能提高生成气体的反应速率,故B错误;
C、压强只对气体的反应速率有影响,对非气体的反应没有影响,增大压强速率不变,故C错误;
D、将Al片改成Al粉,增大了反应物的接触面积,所以能使反应速率加快,故D正确;
故选:D.
本题解析:
本题难度:一般
2、填空题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
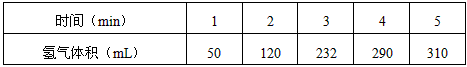
(1)哪一时间段(指0~1.1~2.2~3.3~4.4~5 min)反应速率最大_______________,原因是
_____________________________ 。
(2)哪一段时段的反应速率最小_______________,原因是__________________________。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)_________________。
(4)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率____________(设溶液体积不变,要写出计算过程)。
参考答案:(1)2~3 min;因该反应是放热反应,2~3 min时温度高
(2)4~5 min;因为4~5 min时H+浓度小
(3)AB
(4)0.1 mol/(L·min)
本题解析:
本题难度:一般
3、简答题 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操?作 | 实验现象
①
分别在试管A、B中加入?5mL?5%?H2O2溶液,各滴入1~2?滴1mol/L?FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中.
试管A中不再产生气泡,试管B中产生的气泡量增大
②
另取两支试管分别加入?5mL?5%H2O2溶液和?5mL
10%H2O2溶液.
试管A、B中均未见气泡产生
|
(1)过氧化氢分解的化学方程式为______.
(2)实验①的目的是______,实验中滴加FeCl3溶液的目的是______.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______(用实验中所提供的几种试剂).
(4)某同学在50mL?H2O2?溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______.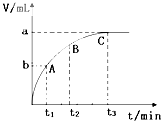
参考答案:(1)过氧化氢分解,FeCl3在此反应中作催化剂,起催化作用,能加快过氧化氢分解产生氧气的速率,故答案为:2H2O2?FeCl3?.?2H2O+O2↑;?
(2)分别在试管A、B中加入?5mL?5%?H2O2溶液,各滴入1~2?滴1mol/L?FeCl3溶液.待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响,而开始加滴加FeCl3溶液,目的加快H2O2分解,故答案为:研究温度对H2O2分解速率的影响;加快H2O2分解速率,使实验现象易于观察;
(3)影响化学反应速率的外界因素有浓度、温度、气体的压强、催化剂、固体的表面积,另取两支试管分别加入?5mL?5%H2O2溶液和?5mL10%H2O2溶液,试管A、B中均未见气泡产生,为加快反应速率,可从温度、或催化剂的影响角度考虑,
故答案为:将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L?FeCl3溶液,观察产生气泡的速率;?
?(4)该图象横坐标表示时间,纵坐标表示生成气体的体积,时间越短生成的气体越多,反应速率越快,所以速率最慢的为C,故答案为:C点的即时速率.
本题解析:
本题难度:一般
4、选择题 下图表示反应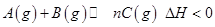 ,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是
,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是
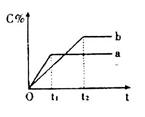
A.反应由逆反应开始
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.若其它条件相同,a比b的温度高
参考答案:D
本题解析:A、从图来看,C的含量从无到有,说明反应由正反应开始,错误;B、ab曲线说明化学平衡移动了,而使用催化剂只能改变反应速率,不能使平衡移动,错误;C、若n=2反应前后气体体积不变,改变压强只改变反应速率,错误;D、该反应正反应放热,升温使化学平衡左移,C的含量减少,a比b的温度高,正确。
本题难度:一般
5、选择题 设C+CO2 2COΔH >0?反应速率为V1;N2+3H2
2COΔH >0?反应速率为V1;N2+3H2 2NH3 ΔH﹤0反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为(?)
2NH3 ΔH﹤0反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为(?)
A.同时增大
B.同时减少
C.V1增大,V2减小
D.V1减小,V2增大
参考答案:A
本题解析:升高温度正逆反应速率都是增大的,所以选项A正确,答案选A。
本题难度:一般