1、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是( )
A.增加反应物的物质的量
B.升高温度
C.缩小反应容器的体积
D.加入MnO2粉末
参考答案:A.增加反应物的物质的量,若反应物为纯固体或液体,反应速率不变,故A不选;
B.升高温度,反应速率加快,故B选;
C.缩小反应容器的体积,若没有气体参加反应,则反应速率不变,故C不选;
D.因催化剂具有专一性,则加入MnO2粉末对某反应不一定作催化剂,则反应速率不一定加快,故D不选;
故选B.
本题解析:
本题难度:一般
2、选择题 工业生产硫酸时,其中一步反应是2SO2 + O2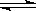 ?2SO3,下列说法错误的是(? )
?2SO3,下列说法错误的是(? )
A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.达到化学平衡时正逆反应速率相等且都为零
参考答案:D
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以选项D是错误的,其余都是正确的,答案选D。
本题难度:一般
3、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
实验编号
| 反应物
| 催化剂
|
①
| 10 mL 2% H2O2溶液
| 无
|
②
| ?
| 无
|
③
| 10 mL 5% H2O2溶液
| MnO2固体
|
?
A.5 mL 2% H2O2溶液?B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液?D.5 mL 10% H2O2溶液
参考答案:B
本题解析:根据定一议二的原则可知,在实验①②中均没有使用催化剂,因此改变的条件应该是双氧水的浓度。由于所以③中使用了催化剂,所以实验②③中改变的条件是催化剂,这说明实验②中反应物与实验③中反应物完全相同,所以实验②的反应物应该是10 mL 5% H2O2溶液,答案选B。
本题难度:一般
4、选择题 下列四个试管中发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
| 试管 | 盐酸浓度 | 温度 | 锌的状态
A
0.5mol?L-1
30℃
块 状
B
0.5mol?L-1
30℃
粉末状
C
1mol?L-1
35℃
块 状
D
1mol?L-1
35℃
粉末状
|
A.A
B.B
C.C
D.D
参考答案:对于反应Zn+2HCl=ZnCl2+H2↑来说,盐酸浓度越大,反应温度越高,固体的表面积越大,则反应速率越大,反之越小,
故选A.
本题解析:
本题难度:简单
5、选择题 右图所示是可逆反应X2+3Y2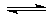 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t1时,只有正向反应
B.t2时反应达到限度
C.t2-t3时,反应停止
D.t2-t3时,v(Y2)=v(Z)
