1、选择题 一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A.缩小体积
B.恒容,充入He
C.恒容,充入O2
D.恒压,充入N2
参考答案:B
本题解析:A、缩小体积,增大压强,反应速率增大,A不正确;B、恒容,充入He,压强增大,但物质的浓度不变,反应速率不变,B正确;C、恒容,充入O2,增大反应物浓度,反应速率增大,C不正确;D、恒压,充入N2,容器的容积扩大,物质的浓度降低,反应速率降低,D不正确,答案选B。
本题难度:一般
2、选择题 下列图示与对应的叙述不相符的是( )
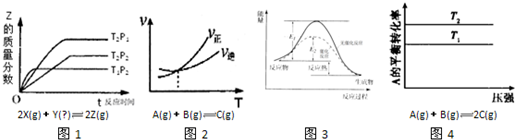
A.图1可以判断出Y的状态为气态,△H<0
B.图2可以判断出反应的△H>0
C.图3表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4可以判断出反应的△H<0,T2>T1
参考答案:A、由图1可知,P1>P2,T1>T2,压强越高,Z的质量分数越高,平衡向正反应移动,增大压强平衡向气体体积减小的方向移动,故Y为气体.温度越高,Z的质量分数越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,所以正反应为放热反应,即△H<0,故A正确;
B、由图2可知平衡后,升高温度,正反应速率高于逆反应速率,平衡向正反应影响,升高温度平衡向吸热方向移动,故该反应正反应为吸热反应,即△H>0,故B正确;
C、由图3可知,反应物的总能量高于生成物的总能量,故反应放热反应;虚线表示的活化能降低,为使用催化剂,表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故C错误;
D、由图4可知,增大压强A的转化率不变,反应前后气体的物质的量相等;A转化率温度T2时比温度T1时高,不能判断温度高低与反应热效应,故D错误.
故选CD.
本题解析:
本题难度:简单
3、简答题 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2gCuSO4?5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是______(填实验序号)
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据如下:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据
④
1.2g
无其他物质
⑤
1.2g
CuO?0.5g
⑥
1.2g
MnO2?0.5g
|
回答下列问题:
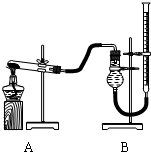
(2)上述实验中的“待测数据”指______;
(3)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,______;
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.______,b.CuO的化学性质有没有改变.
参考答案:(1)①溶解过程中用玻璃棒搅拌,加快溶解速度;②中用玻璃棒转移固体;③中用玻璃棒引流液体.
故答案为:①②③
(2)证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较,对比实验一定要控制变量,此实验中应控制氯酸钾质量、气体的体积、氧化铜与二氧化锰的质量相等,可变的量是生成等体积(25mL)气体所需用的时间.
故答案为:生成25mL气体所需的时间
(3)利用氧气的助燃特点,检验氧气的方法为:取一根带火星的木条,伸入干燥管内,松开弹簧夹,看木条是否复燃.
故答案为:取一根带火星的木条,伸入干燥管内,松开弹簧夹,看木条是否复燃.
(4)催化剂是能改变化学反应速度,而本身质量和化学性质不变,故还应检验氧化铜的质量是否改变.
故答案为:CuO的质量有没有改变
本题解析:
本题难度:一般
4、选择题 下列实验中,反应速率加快是由催化剂引起的是
[? ]
A.将炭块粉碎成粉末状,可使燃烧更加充分
B.过氧化氢中加入几滴氯化铁溶液,即可较快放出气体
C.在炭粉中加入氯酸钾,点燃时燃烧更为剧烈
D.用锌与稀硫酸反应制备氢气时,加入少量浓硫酸加快反应
参考答案:B
本题解析:
本题难度:一般
5、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由下图表示。在下列因素中:
①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
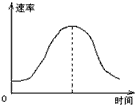
[? ]
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:
本题难度:一般