1、简答题 有四组物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| ① | He-268.8 | Ne-249.5 | Ar(x) | Kr-151.7
②
F2-187.0
Cl2-33.6
(a)58.7
I2-184.0
③
HF(Y)
HCl-84.0
HBr-67.0
HI-35.3
④
H2O(Z)
H2S-60.2
(b)-42.0
H2Te-1.8
|
试根据上表回答下列问题:
(1)物质b的分子式为:______,物质______(填a或b)易溶于苯.
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是______.
(3)上表中,______和______两种物质的沸点较同系列其它物质反常,反常的主要原因是______.
参考答案:(1)第VIA主族元素从上到下分别为:O、S、Se、Te,则物质b的分子式为:H2Se;a为Br2,是非极性分子,易溶于有机溶剂苯,b为H2Se,是极性分子,难溶于苯,故a易溶于苯;
故答案为:H2Se;a;
(2)由表中数据判断沸点的变化规律:结构和组成相似的物质,其沸点随相对分子质量的增大而升高;
故答案为:结构和组成相似的物质,其沸点随相对分子质量的增大而升高;
(3)分子间能形成氢键的物质熔沸点较高,HF、H2O分子之间存在较强的氢键而其他氢化物分子间只存在较弱的范德华力,所以HF、H2O的沸点较同系列其它物质反常;
故答案为:HF、H2O;HF、H2O分子之间存在较强的氢键而其他氢化物分子间只存在较弱的范德华力.
本题解析:
本题难度:一般
2、选择题 下列物质的按熔沸点升高顺序排列的是
A.Li Na K Rb
B. NaF NaCl NaBr NaI
C.F2 Cl2 Br2 I2
D.H2O H2S H2Se H2Te
参考答案:C
本题解析:碱金属自上而下熔沸点逐渐降低,A不正确。氟化钠中离子键最强,所以选项B中熔沸点逐渐降低,不正确。第ⅦA自上而下单质熔沸点逐渐升高,C正确。水中含有氢键,在选项D中水的熔沸点最高,不正确。答案选C。
本题难度:简单
3、选择题 下列有关金属晶体的说法中不正确的是(? )
A.金属晶体是一种“巨分子”
B.“电子气”为所有原子所共有
C.简单立方堆积的空间利用率最低
D.钾型堆积的空间利用率最高
参考答案:D
本题解析:根据金属晶体的电子气理论,A、B选项都是正确的。金属晶体的堆积方式中空间利用率分别是:简单立方52%,钾型68%,镁型和铜型均为74%。因此简单立方的空间利用率最低,镁型和铜型的空间利用率最高,因此应选择D项。
本题难度:一般
4、选择题 干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
物质
| 干燥效率
| 物质
| 干燥效率
|
MgO
| 0.008
| ZnCl2
| 0.8
|
CaO
| 0.2
| ZnBr2
| 1.1
|
?
分析以上数据,下列有关叙述错误的是
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
参考答案:D
本题解析:干燥效率是1m3空气中实际余留水蒸气的质量 。所以干燥效率越小,干燥效果就越好。MgO的干燥效率为0.008<0.2(CaO的干燥效率),所以MgO的干燥性能比CaO好 。正确。B.Mg、Ca是同一主族的元素,Cl、Br也是同一主族的元素,原子半径Ca>Mg,Br>Cl ,而干燥效率CaO>MgO,ZnBr2>ZnCl2.可见原子半径越大,干燥效率越大。正确。C.根据表格中的数据可以推知:干燥效率CaCl2>MgCl2,所以MgCl2可能是比CaCl2更好的干燥剂。正确。D.根据表格数据可看出在上述干燥剂中阳离子和阴离子都会对干燥效率产生较大的影响。错误。
本题难度:一般
5、选择题 下列说法错误的是(? )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1?mol金刚石晶体中,平均含有2?mol?C-C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D.
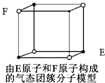 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
参考答案:D
本题解析:
本题难度:一般