1、选择题 下列关于晶体的说法一定正确的是(?)
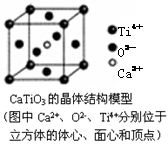
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.熔融时化学键没有破坏的晶体一定是金属晶体
参考答案:B
本题解析:分子晶体中不都存在共价键,例如稀有气体的晶体,其中不含有共价键,故A错误;从图可以看出CaTiO3晶体中每个Ti4+和12个O2-相紧邻,故B正确;SiO2晶体中每个硅原子与四个氧原子以共价键相结合,故C错误;熔融时化学键没有破坏的晶体不一定是金属晶体,例如分子晶体熔融有些化学键也没有变化,故D错误。
点评:本题考查了晶体类型,该考点是高考考查的重点和难点,本题要掌握的是SiO2晶体中每个硅原子与四个氧原子以共价键相结合,是四个氧原子,而不是两个,本题难度中等。
本题难度:一般
2、选择题 有四种晶体,其离子排列方式下图所示,其中化学式不属AB型的是?(?)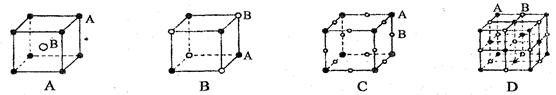
参考答案:C
本题解析:略
本题难度:简单
3、填空题 (共3分)铜及其合金是人类最早使用的金属材料。
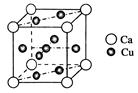
(1)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为________。
(2)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
②某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH==CH2―→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为______________。
参考答案:(1)1∶5?(2)①平面正方形 ?② sp2
本题解析:(1)根据晶胞结构示意图可知Ca位于顶点上,所以含有的个数是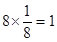 。其中8个Cu位于面心出,1个位于体心,因此含有的个数是1+8×1/2=5,所以Ca和Cu的原子个数比为1∶5?。
。其中8个Cu位于面心出,1个位于体心,因此含有的个数是1+8×1/2=5,所以Ca和Cu的原子个数比为1∶5?。
(2)[Cu(NH3)4]2+具有对称的空间构型,则可能是平面正方形或是正四面体型。[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,因此只能是平面正方形。
(3)根据结构简式可判断丙烯醇中1个碳原子是sp3杂化,2个是sp2杂化。在丙醛中则是,1个是sp2杂化,2个碳原子是sp3杂化。
本题难度:一般
4、选择题 磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。下图是Mn和Bi形成的某种晶体的结构示意图,则该晶体物质的化学式可表示为
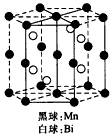
[? ]
A. Mn2Bi
B. MnBi
C. MnBi3
D. Mn4Bi3
参考答案:B
本题解析:
本题难度:一般
5、填空题 在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是___________________;
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的偶极矩由大到小的排列顺序是:___________________;
(3)实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是___________构型,BC13分子是______________构型。
(4)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。试画出两种异构体的构型图,并比较在水中的溶解度。构型图:
在水中溶解度较大的是___________________。
参考答案:(1)CS2
(2)邻>间>对
(3)三角锥形;平面三角形
(4)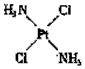 ;
;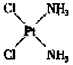 ;棕黄色者
;棕黄色者
本题解析:
本题难度:一般