1、选择题 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa
体积分数/%
温度/℃
| 1.0
| 2.0
| 3.0
|
810
| 54.0
| a
| b
|
915
| c
| 75.0
| d
|
1000
| e
| f
| 83.0
|
?
①b<f?②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0?④K(1000℃)>K(810℃)
上述①~④中正确的有(? )
A.4个? B.3个? C.2个? D.1个
参考答案:A
本题解析:该反应的气体系数由1变为2,气体的物质的量增大,则?S>0,③正确;设E的初始物质的量为n,反应的物质的量为x,则生成G的物质的量为2x,平衡时G的体积分数为75.0%。可得2x/(n-x+2x)=75.0%,得x=0.6n,E的转化率为60%,故②正确;根据表中给出的三个体积分数可以看出,随着压强增大、温度升高,平衡时G的体积分数增大,而压强增大,化学平衡向逆反应方向移动,说明温度升高一定使平衡向正反应方向移动,正反应为吸热反应,④正确;f比b的温度高,压强小,使平衡向正反应方向移动,①正确。
【考点定位】本题考查温度、压强对化学平衡的影响、转化率的计算、?S的判断以及平衡常数的比较。
本题难度:简单
2、选择题 在体积为VL的密闭容器中进行如下反应:mA+nB=pC+qD。用A物质的物质的量浓度变化表示平均反应速率为am/p mol/(L·min),则t min时,D物质增加的物质的量是
[? ]
A.(patm/q)mol
B.(atm/q)mol
C.(qatV/p)mol
D.(aVm/p)mol
参考答案:C
本题解析:
本题难度:简单
3、选择题 一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为64,将2molH2和2molX2通入体积为1L的密闭容器中,该温度下H2的平衡转化率为( )
A.20%
B.40%
C.60%
D.80%
参考答案:设得到平衡时氢气的转化率为x,
反应方程式 H2(g)+X2(g)?2HX(g)
反应前 2mol 2mol 0
变化2xmol 2xmol 4xmol
平衡状态2mol-2xmol 2mol-2xmol 4xmol
该温度下,平衡常数K=(4x1)2(2-2x1)?(2-2x1)=64,
解得x=43(舍弃)或x=0.8,
所以D正确,
故选:D.
本题解析:
本题难度:简单
4、计算题 将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2(g)+O2 (g)
2H2(g)+O2 (g)
2CO(g)+O2 (g) 2CO2 (g)
2CO2 (g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_______和_______,或_______和_______。
(2)若平衡时O2和CO2的物质的量分别为n(H2O)="_________" mol(用含a、b的代数式表示)。
参考答案:(1)H2O? H2?CO? CO2
(2)(2-2a-b)
本题解析:(1)设达到平衡时,H2O和CO分别反应了的物质的量为x和y。
2H2O 2H2O? +? O2
2H2O? +? O2
始/mol? 2? 0?2
反/mol? x? x?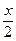
平/mol? 2-x? x?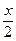
2CO? +? O2 ?2CO2
?2CO2
始/mol? 2?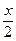 ?0
?0
反/mol? y?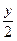 y? y
y? y
平/mol? 2-y?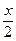 -
-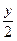 ? y
? y
由上可知,平衡时各物质的物质的量跟x或y有关,列二元一次方程组可求出各物质的物质的量。
可见:知两物的平衡浓度,不能同时为H2O、H2和CO、CO2。
(2)依题意可列: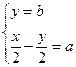
解得:x=2a+b,则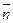 ?(H2O)="2" mol-x="(2-2a-b)" mol。
?(H2O)="2" mol-x="(2-2a-b)" mol。
本题难度:简单
5、选择题 对于反应A2+3B2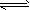 2AB3以下表示的反应速率中,速率最大的是
2AB3以下表示的反应速率中,速率最大的是
[? ]
A.vA2=0.4mol·L-1·min-1
B.vB2=0.8mol·L-1·min-1
C.vAB3=0.6mol·L-1·min-1
D.vA2=0.01mol·L-1·s-1
参考答案:D
本题解析:
本题难度:简单