1、简答题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)W元素在周期表中的位置为______;写出Y元素原子的价电子排布式:______;
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的分子属于______(填“极性”、“非极性”)分子.
(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g?C气体(已知n(X):n(Y)=3:1)可放出18.44kJ热量,则该反应的热化学方程式为______.
(4)由X、Y、Z、W四种元素组成的一种离子化合物D
①已知1mol?D能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下D与NaOH溶液反应的离子方程式______.
②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式______.
(5?)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为______.
参考答案:原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为氢元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为
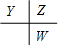
,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素.
(1)W为硫元素,原子核外有16个电子,有3个电子层,最外层电子数为6,位于周期表中第三周期第VⅠA族;?Y为氮元素,原子核外有7个电子,核外电子排布式为1S22S22P3,氮原子价电子排布式?2S22P3.
故答案为:第三周期第VⅠA族;?2S22P3.
(2)X为氢元素,Y为氮元素,由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,则A为N2H4,B为NH3,N2H4分子中氮原子与氮原子之间形成N-N单键,每个N原子还形成2个N-H键,N原子有1对孤对电子对,N原子的杂化轨道数为4,N原子采取sp3杂化,呈三角锥,两个-NH2分别位于类似打开书页的页面内,与过氧化氢类似,分子不对称,为极性分子.
故答案为:极性.
(3)X为氢元素,Y为氮元素,一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g?C气体,可放出18.44kJ热量,C为NH3,6.8gNH3的物质的量为6.8g17g/mol=0.4mol,所以生成2molNH3,放出的热量为18.44kJ×2mol0.4mol=92.2kJ,则该反应的热化学方程式为N2(g)+3H2(g)?

?2NH3?(g)△H=-92.2?kJ/mol.
故答案为:N2(g)+3H2(g)?

?2NH3?(g)△H=-92.2?kJ/mol.
(4)由X、Y、Z、W四种元素组成的一种离子化合物D,则D为硫酸形成的铵盐或亚硫酸形成的铵盐.
①D为硫酸形成的铵盐或亚硫酸形成的铵盐,1mol?D能与足量NaOH浓溶液反应生成标准状况下44.8L气体,该气体为氨气,物质的量为2mol,则D为硫酸铵或亚硫酸铵,加热条件下D与NaOH溶液反应的离子方程式为NH4++OH-??△?.?H2O+NH3↑.
故答案为:NH4++OH-??△?.?H2O+NH3↑.
②D既能与盐酸反应,又能与氯水反应,结合①可知D为亚硫酸铵,Cl2将SO32-氧化为SO42-,自身被还原为Cl-,
反应的离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+.
故答案为:SO32-+Cl2+H2O═SO42-+2Cl-+2H+.
(5?)氢气与氧气在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,原电池负极发生氧化反应,则氢气在负极放电,正极反应还原反应,则氧气在正极放电,所以M极通氢气,N极通氧气,碱性条件下,氢气放电生成水,则M极的电极反应式为 H2+2OH--2e-═2?H2O.
故答案为:H2+2OH--2e-═2?H2O.
本题解析:
本题难度:一般
2、选择题 下列有关“核外电子的运动状态”的说法,错误的是( )
A.各原子轨道的伸展方向按p、d、f的顺序分别为3、5、7
B.核外电子云表示电子在核外单位体积的空间出现的机会多少
C.原子轨道伸展方向与能量大小是无关的
D.原子核外可能有两个电子的运动状态是完全相同的
参考答案:D
本题解析:
本题难度:一般
3、填空题 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素
试回答下列问题:
(1)表中第一电离能最小的是______(填字母,下同),第一电离能最大的是______.c、d、e三种元素的第一电离能由大到小的顺序是______,它们与a元素形成的最简单化合物的热稳定性由强到弱的是______(填化学式).
(2)第三周期中由电负性最大的元素与电负性最小的元素组成的化合物化学式是______.
(3)表中基态原子的未成对电子数最多的元素是______,其二价阳离子的外围电子排布式是______.
(4)写出由a、d、e三种元素组成的一种离子化合物的化学式______,并用离子方程式来说明其水溶液显酸性的原因______.
参考答案:(1)同一周期自左而右,第一电离能呈增大的趋势,同主族自上而下,第一电离能逐渐降低,故第一电离能最小的应在周期表的左下方,为n元素(即K元素),第一电离能最大的元素应在周期表的右上方,但稀有气体的第一电离能最大为m元素(即Ar元素);由元素在周期表中的位置可知,c、d、e三种元素分别为C、N、O元素,N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素,故三种元素的第一电离能由大到小的顺序是d>e>c;a为H元素,三者与a形成的化合物为氢化物,同周期自左而右,非金属性增强,非金属性O>N>C,非金属性越强,氢化物越稳定,故氢化物稳定性H2O>NH3>CH4.
故答案为:n,m,d>e>c,H2O>NH3>CH4.
(2)同周期自左而右,电负性增大,故第三周期中电负性最大的元素是Cl,电负性最小的元素是Na,二者形成的物质化学式为NaCl.
故答案为:NaCl.
(3)表中基态原子可以形成+2离子,属于金属,未成对电子数最多,故为过渡元素中的o(Fe元素),Fe元素核外电子排布为1s22s22p63s23p63d64s2,故Fe2+的外围电子排布式为3d6.
故答案为:o(Fe元素);3d6.
(4)由元素在周期表中的位置可知,a为H元素、d为N元素、e为O元素,三种元素组成的一种离子化合物为NH4NO3,铵根离子水解NH4++H2O

NH3?H2O+H+,使溶液呈酸性.
故答案为:NH4NO3;NH4++H2O

NH3?H2O+H+.
本题解析:
本题难度:一般
4、选择题 在基态多电子原子中,关于核外电子能量的叙述错误的是
[? ]
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
参考答案:C
本题解析:
本题难度:简单
5、简答题 化学选做题----物质结构
铜是过渡元素.化合物中,铜常呈现+1价或+2价.
(1)写出Cu+的电子排布式______.
(2)如图为某铜矿晶体结构单元,该铜矿的化学式______.
(3)已知,铜的第一电离能为746kJ?mol-1,第二电离能为1958kJ?mol-1.请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因______
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大.据此可知,CuCl的溶解度比CuI的溶解度______(填“大”或“小”).
(5)CO、NH3都能提供孤电子对与Cu+形成配合物.Cu+与NH3形成的配合物可表示为[Cu(NH3)?n]+.该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对.
①[Cu(NH3)n]+中n=______;
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈______型.
③[Cu(NH3)?n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的作用力是______.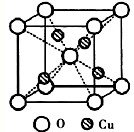
参考答案:(1)Cu的电子排布式为1s22s22p63s23p63d104s1,失去一个电子后生成Cu+,其电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)根据晶胞结构可知,O位于顶点和体心,共有:8×18+1=2个,Cu位于体心,共4个,n(Cu):n(O)=2:1,所以化学式为Cu2O,故答案为:Cu2O;
(3)失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,
故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(4)Cl的非金属性比I大,铜与Cl形成的化学键极性更强,对应的CuCl的溶解度较大,故答案为:大;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,
故答案为:①2;②直线;③配位键.
本题解析:
本题难度:一般